УДК 619:616.98:578.
Ольга Александровна Акимова, научный сотрудник, zvff.nxvzbin-bytn2015@lnaqrk.eh
Антон Геннадьевич Южаков, к.б.н., начальник отдела, nagba_bfxby@znvy.eh,
https://orcid.org/0000-0002-0426-9678,
Марина Александровна Корицкая, к.в.н., ведущий специалист
Евгений Валерьевич Иванов, к.б.н., ведущий научный сотрудник, doctor2112@yandex.ru
Голда Артуровна Джавадова, специалист по диагностическим
тест-системам, goldajavadova@gmail.com
ООО «Ветбиохим» (Москва, Россия)
Александр Гаврилович Глотов, д.в.н., профессор, заведующий лабораторией, tybgbi_irg@znvy.eh
Татьяна Ивановна Глотова, д.б.н., профессор, главный научный сотрудник, g-tybgbin@znvy.eh
ФГБУН Сибирский федеральный научный центр агробиотехнологий РАН (СФНЦА РАН), Институт экспериментальной ветеринарии Сибири и Дальнего Востока (пос. Краснообск, Новосибирская обл., Россия).
Олег Анатольевич Верховский, д.б.н., профессор, заведующий отделом, vasb@qcev.eh
АНО «Научно-исследовательский институт диагностики и профилактики болезней человека и животных» (Москва, Россия)
Тарас Иванович Алипер, д.б.н., профессор, aliper@vetbio.ru
ООО «Ветбиохим» (Москва, Россия)
Вирусная диарея крупного рогатого (ВД КРС) – инфекционная контагиозная болезнь, характеризующаяся многообразием клинической картины, в основном воспалениями и язвами на слизистых оболочках пищеварительного тракта, диареей, лихорадкой, поражениями репродуктивной системы животных. Заболевание наносит значительный экономический ущерб животноводству, связанный с абортами, рождением мертвых телят или с врожденными пороками развития, а также персистентно инфицированных (ПИ) животных [1, 2, 18].
Согласно современной классификации возбудителями ВД КРС, являются 3 вида (типа) вирусов относящихся к семейству Flaviviridae, роду Pestivirus: Pestivirus A (BVDV1, ВВД 1), Pestivirus B (BVDV2, ВВД 2) и Pestivirus H (HoBiPeV, BVDV3, Hobi-like, ВВД 3). Геном пестивирусов представлен однонитевой РНК положительной полярности, длиной 12,3 тыс. нуклеотидов. Вирионы имеют сферическую форму, их диаметр от 40 до 60 Нм [13, 15]. Они содержат четыре структурных белка: основной белок ядра нуклеокапсида С (14 кДа) и три гликопротеина оболочки – Erns (gp44 / 48), E1 (gp33) и E2 (gp55). Все три гликопротеина представлены в виде межмолекулярных дисульфидно-связанных комплексов: гомодимеры Erns, гетеродимеры E1 – E2 и гомодимеры E2. Геном пестивирусов кодирует 8 неструктурных (NS) белков, среди которых Npro (23 кДа), p7 (7 кДа) и NS2 (40 кДа) не являются необходимыми для репликации РНК [8].
Вирусы ВД 1 и ВД 2 КРС – типичные и хорошо известные пестивирусы. В отличие от них вирус ВД 3 относится к группе атипичных пестивирусов крупного рогатого скота, до настоящего времени они практически не изучены в качестве инфекционного этиологического агента ВД КРС. Вирус ВД 3 впервые обнаружили в изготовленной в Бразилии партии эмбриональной сыворотки крови крупного рогатого скота, используемой в биологической промышленности [19, 21]. Затем его выявили в зараженной культуре клеток и крови буйвола в Южной Америке [20]. В Италии в 2010 г. вирус выделили от телят во время вспышки респираторной болезни и при персистентной форме инфекции [10]. В Бразилии и Китае описаны случаи респираторного заболевания у телят, вызванные вирусом ВД 3 [14], характеризующиеся не только респираторным синдромом, но и кишечными проявлениями, а также высокой летальностью [16].
Пути передачи вируса ВД 3 разнообразны и аналогичны другим пестивирусам крупного рогатого скота. Возбудитель может передаваться горизонтально воздушно-капельным или фекально-оральным способом, а также вертикально от матери потомству. Подтверждены случаи распространения ВВД 3 при массовом применении живых вакцин, для изготовления которых случайно могли использовать контаминированную эмбриональную сыворотку крови [12, 16]. Итальянские ученые при исследовании in vitro показали, что вирус ВД 3 может реплицироваться в тех же культурах клеток, что и типичные пестивирусы крупного рогатого скота, без проявления цитопатического действия [17].
Широкое распространение вируса ВД 3 в мире через контаминированные вакцины и ветеринарные препараты, а также его способность вызывать поражения респираторной и репродуктивной систем, заставляют пристально следить за данным возбудителем.
Настоящая работа посвящена впервые обнаруженному и идентифицированному вирусу ВД 3 при вспышке заболевания на животноводческом комплексе одного из хозяйств Российской Федерации, разработке тест-системы ПЦР в режиме «реального времени» (ПЦР-РВ) для выявления вирусной РНК и молекулярно-биологической характеристике выделенного возбудителя.
Материалы и методы. На молочной ферме с поголовьем 600 дойных коров в одном из хозяйств Новосибирской области РФ исследовали телят 3 – 5-месячного возраста с клиническими признаками респираторного заболевания. От вынуждено убитых особей отобрали пробы патологического материала: кусочки селезенки, подчелюстных, средостенных лимфатических узлов и легких. При их транспортировке соблюдали температурный режим.
Диагностические ПЦР на наличие РНК вирусов ВД КРС, парагриппа типа 3 крупного рогатого скота (ПГ-3), ДНК вируса инфекционного ринотрахеита крупного рогатого скота (ИРТ КРС) осуществляли с помощью соответствующих коммерческих тест-систем по методике производителя (Ветбиохим, Россия). Наличие РНК респираторно-синцитиального вируса крупного рогатого скота (РС КРС), коронавируса крупного рогатого скота (КВ КРС) и ротавируса крупного рогатого скота (РВ КРС) контролировали по ранее описанным методикам [4 – 6].
Фрагменты генома для секвенирования амплифицировали при помощи ранее написанных олигонуклеотидных праймеров VD-F 5’-TTA AGCCCTGAGTACAGGG-3’ (позиции 170 – 188 по штамму NADL), VD-R 5’-TTTGTTTGTATGTTTTGTAT-3’ (позиции 431 – 412 по штамму NADL), фланкирующих консервативный регион вирусного генома размером 261 пар оснований. ОТ-ПЦР проводили в конечном объеме 25 мкл. Реакционная смесь содержала 5 мкл выделенной РНК, 10 пМ каждого праймера, 0,25 мM каждого dNTP, 1,25 ед. Taq-полимеразы, 0,5 ед. M-MLV ревертазы, 20 ед. ингибитора рибонуклеаз RNAzin, 10 мM Tris-HCl (рН 9,0), 50 мM KCl, 0,1% Triton X-100, 1,5 мM MgCl2. Температурный режим реакции: 50 0С – 30 мин, 94 0С – 5 мин 1 цикл, 94 0С – 20 с, 50 0С – 20 с, 72 0С – 20 с 30 циклов, 72 0С – 5 мин. Продукты ПЦР анализировали в 1%-ном агарозном геле в трис-ацетатном буфере. Полученный фрагмент вырезали и изолировали из геля при помощи набора LumiPure для выделения ДНК из агарозного геля и реакционных смесей (Lumiprobe, Россия) по методике производителя. Секвенирование осуществляли с тех же праймеров. Анализировали последовательности с помощью пакетов программ: LaserGene 11.1.0. (DNASTAR, США) и MEGA 7.0.18 (MegaSoftware, США).
Из патологического материала, в котором обнаружили геном вируса ВД 3, готовили 10%-ную суспензию на фосфатно-буферном растворе (рН 7,2 – 7,4) с добавлением антибиотиков пенициллина (400 ед/мл), стрептомицина (300 ед/мл) и канамицина (100 ед/мл) и центрифугировали 30 мин при 3000 об/мин. Надосадочную жидкость фильтровали с использованием фильтрующего элемента с диаметром пор 0,22 мкм. [3] Полученным материалом заражали первичную культуру клеток почки теленка (ПТ), субкультуры тестикул бычка, тестикул козла, тестикул ягненка (ТЯ), перевиваемую линию клеток почки крупного рогатого скота (MDBK) и перевиваемую линию клеток сердца теленка (КСТ). Клетки выращивали в монослое методом стационарного культивирования с применением питательной среды ДМЕМ (HyClone, США) и добавлением 10%-ной эмбриональной сыворотки крови КРС (FBS HyClone, США). Монослой клеток, сформированный на 80 – 90%, промывали солевым раствором Хэнкса, инокулировали 500 мкл вирусной суспензии и инкубировали 1 ч при 37 0С для адсорбции вируса. После этого инокулят удаляли и вносили поддерживающую среду ДМЕМ с добавлением 1% эмбриональной сыворотки крови КРС (FetalClone III, HyClone, США). За инфицированными культурами клеток наблюдали в течение 5 суток.
При разработке праймеров и зондов для детекции РНК ВД 3 использовали 66 полных геномов вирусов ВД из базы данных GenBank: 20 – ВД 3, 23 – ВД 1 и 23 – ВД 2. Нуклеотидные последовательности каждого вида выравнивали относительно друг друга, на этой основе сгенерировали консенсусные последовательности, используемые для подбора праймеров и зондов.
Результаты исследований и обсуждение. В ноябре 2020 г. на молочной ферме Новосибирской области РФ зафиксировали респираторное заболевание молодняка крупного рогатого скота. У телят отмечали угнетение, обильное слюнотечение, образование пенистой массы вокруг ротовой полости и белый налет на языке. В дальнейшем у них развивался конъюнктивит, наблюдали выделение серозного и гнойного экссудата из носовой полости (рис. 1). Края носового зеркала покрывались трескающимися корочками. При этом температура тела была в пределах нормы, аппетит сохранен. Спустя 2 – 3 недели у некоторых животных развивалась диарея. Зарубежные исследователи в своих работах описывают сходный комплекс симптомов у заболевшего молодняка [11].

Рис. 1. Клинические признаки у теленка
При исследовании образцов патологического материала вынужденно убитых телят методом ПЦР выявили РНК вируса ВД (без видовой дифференциации), геномы вирусов РС, ПГ-3, КВ, РВ и ИРТ КРС не обнаружили. Для идентификации и генотипирования вируса образцы, содержащие РНК вируса ВД КРС, использовали для амплификации и последующего секвенирования фрагмента генома, содержащего участок 5’ НТО и участок гена Npro вируса ВД КРС для определения его вида. Анализ полученной последовательности в программе BLAST показал, что исследуемый геном принадлежит вирусу ВД КРС 3 типа, а филогенетически установили, что наиболее близкими к нему являются штаммы вируса ВД 3 из Италии и Бразилии (рис. 2). В связи с этим, нами был сделан вывод, что этиологическим агентом, вызвавшим заболевание телят, является вирус ВД КРС 3 типа.
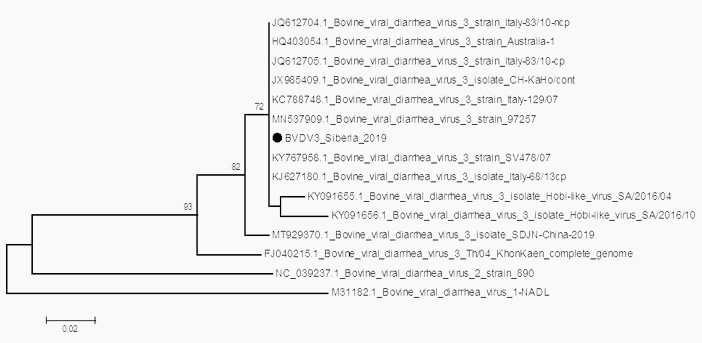
Рис. 2. Филогенетическая дендрограмма, основанная на фрагменте генома вирусов ВД
Для выявления РНК вируса ВД 3 КРС разработали тест-систему ПЦР-РВ, с этой целью на основе консенсуной последовательности геномов ВД-3 выбрали следующие праймеры и зонд к ним: BVDV3 F (5’-CAGTGAGCTCCTTGGATTA- 3'); BVDV3 R (5’-ACCCTCTTTCACCCAAG- 3') и BVDV3 Probe (FAM-ATGCCTCGAGATGCCATGTGGA-BHQ1). Консенсусные последовательности ВД 1 и ВД 2 использовали для теоретического исключения ложноположительных реакций с данными вирусами. Для достижения максимальной чувствительности оптимизировали состав ПЦР смеси и температурные условия реакции. В дальнейшей работе реакционная смесь для ПЦР (в конечном объеме 25 мкл) содержала 5 мкл выделенной РНК, 10 пМ каждого праймера, 5 пМ зонда, 0,25 мM каждого dNTP, 1,25 ед. Taq-полимеразы, 0,5 ед. ревертазы M-MLV, 20 ед. ингибитора рибонуклеаз RNAzin, 50 мM Tris-HCl (рН=8,3), 75 мM KCl, 10 пМ DTT, 3 мM MgCl2. Оптимальный температурно-временной режим для ПЦР-РВ был следующим: 1 цикл – 50 0С − 30 мин, 94 0С − 5 мин; 5 циклов – 94 0С − 10 с, 50 0С − 20 с, 72 0С − 10 с; 40 циклов – 94 0С − 10 с, 50 0С* − 20 с, 72 0С − 10 с (* – измерение уровня флуоресценции).
Специфичность тест-системы проверяли с помощью панели положительных и отрицательных контрольных образцов, включающих культуры клеток Vero и MDBK, инфицированные вирусами ВД 1, ВД 2, ВД 3, ПГ-3, РС и коронавирусом КРС. В результате установили, что в разработанной тест-системе специфично выявляется РНК ВД 3 КРС, при отрицательной реакции с гетерологичными образцами. Таким образом, было показано, что ПЦР-РВ является чувствительным и специфичным тестом, пригодным для идентификации и мониторинга вируса ВД 3 КРС.
При изучении биологических свойств идентифицированного вируса ВД 3 использовали ряд первичных и перевиваемых культур клеток. Так как за время наблюдения цитопатических изменений не обнаружили, то для оценки размножения вируса в культурах клеток применили разработанную нами методику ПЦР-РВ. Размножение вируса ВД 3 отмечали в культурах клеток MDBK (2- и 3-й пассаж) и ПТ (1- и 3-й пассаж), его не удалось зарегистрировать в других культурах клеток. Необходимо отметить, что впервые накопление вируса ВД 3 в культуре клеток MDBK было описано N. Decaro et al. [9].
Заключение. Впервые в Российской Федерации был выделен и идентифицирован вирус ВД 3, установлена его этиологическая роль в возникновении и распространении ВД КРС. Филогенетический анализ участка последовательности генома обнаруженного возбудителя показал, что наиболее близкими к нему являются изоляты вируса ВД 3 из Италии и Бразилии. Выделенный вирус размножается в культурах клеток MDBK и ПТ. Разработана высокоэффективная тест-система на основе ПЦР-РВ для диагностики и мониторинга ВД КРС, вызываемой 3 типом возбудителя, а также для контроля применяемых живых вакцин на отсутствие контаминации вирусом ВД 3 типа.
Литература
- Бессарабов Б. Ф., Вашутин А. А., Воронин Е. С. и др. Инфекционные болезни животных. Под ред. А. А. Сидорчука. М.: КолосС, 2007; 671 с.
- Глотов А. Г., Глотова Т. И. Атипичные пестивирусы крупного рогатого скота. Сельскохозяйственная биология. 2015; 50 (4):399 – 408.
- Дьяконов Л. П., Ситьков В. И. Животная клетка в культуре (Методы и применение в биотехнологии) М.: Компания Спутник +, 2000; 400 с.
- Кудрявцев В. А., Дороненкова Г. Н., Аянот П. К.. Методика выявления и штаммовой дифференциации коронавируса КРС с помощью ПЦР и секвенирования фрагмента S гена. ФГУ «ВНИИЗЖ». Владимир, 2003; 9 с.
- Нестеров А. А., Белый А. С. Методические рекомендации по выявлению РНК вируса респираторно-синцитиальной инфекции крупного рогатого скота с помощью полимеразной цепной реакции в режиме реального времени. ФГБУ «ВНИИЗЖ». Владимир, 2020; 21 с.
- Хаметова К. М., Алексеев К. П., Южаков А. Г., Костина Л. В., Раев С. А., Мусиенко М. И., Мухин А. Н., Алипер Т. И., Воркунова Г. К., Гребенникова Т. В. «Молекулярно-биологические свойства клонированного штамма Wa ротавируса а человека» Вопросы вирусологии, 2019, 64 (1): 16-22.
- Bauermann F. V., Ridpath J. F., Weiblen R., Flores E. F. HoBi-like viruses: an emerging group of pestiviruses. J. Vet. Diagn. Invest. 2013; 25 (1):6 – 15. DOI:10.1177/1040638712473103
- Daniel Aberle, Claudia Muhle-Goll, Jochen Bürck, Moritz Wolf, Sabine Reißer, Burkhard Luy, Wolfgang Wenzel, Anne S. Ulrich, Gregor Meyers. Structure of the Membrane Anchor of Pestivirus Glycoprotein Erns, a Long Tilted Amphipathic Helix. February 27, 2014.
- Decaro N., Mari V., Lucente M. S., Sciarretta R., Moreno A., Armenise C., Losurdo M., Camero M., Lorusso E., Cordioli P., Buonavoglia C. Experimental infection of cattle, sheep and pigs with 'Hobi'-like pestivirus. Vet Microbiol. 2012; Mar 23; 155 (2 – 4):165 – 171. DOI: 10.1016/j.vetmic.2011.08.030. Epub 2011 Sep 3.
- Decaro N., Lucente M. S., Mari V. Atypical pestivirus and severe respiratory disease in calves. Europe. Emerg. Infect. Dis. 2011; 17:1549 – 1552. DOI: 10.3201/eid1708.101447
- Fernando V. Bauermann et al. Anim Health Res Rev. HoBi-like viruses-the typical 'atypical bovine pestivirus'. 2015; Jun.
- Fernando V. Bauermann, Julia F. Ridpath, Rudi Weiblen, Eduardo F. Flores. HoBi-like viruses: an emerging group of pestiviruses. Department of Preventive Veterinary Medicine, Virus Section, Federal University of Santa Maria, Santa Maria, Rio Grande do Sul, Brazil. 2013. https://doi.org/10.1177/1040638712473103
- H. Laude. Nonarbo-togaviridae: comparative hydrodynamic properties of the pestivirus genus. 1979.
- Ingrid Bortolin Affonso Lux Hoppe, Andressa de Souza-Pollo, Andréa Souza Ramos de Medeiros, Samir Issa Samara, Adolorata Aparecida Bianco Carvalho. Adolorata Aparecida Bianco Carvalho. HoBi-like pestivirus infection in an outbreak of bovine respiratory disease. Universidade Estadual Paulista-Unesp, Faculdade de Ciências Agrárias e Veterinárias, Departamento de Medicina Veterinária Preventiva e Reprodução Animal, Via de Acesso Professor Paulo Donato Castellane, s/n°, CEP: 14.884 – 900 Jaboticabal, São Paulo, Brazil. 2019.
- King A. M.Q., Lefkowitz E.J., Mushegian A.R., Adams M. J., Dutilh B. E., Gorbalenya A. E., Harrach B., Harrison R. L., Junglen S., Knowles N. J. et al. Changes to taxonomy and the International Code of Virus Classification and Nomenclature ratified by the International Committee on Taxonomy of Viruses. Arch. Virol. 2018; 163:2601 – 2631.
- Meng Chen, Mengda Liu, Sidang Liu, Yingli Shang. HoBi-like pestivirus infection leads to bovine death and severe respiratory disease in China. College of Veterinary Medicine, Shandong Agricultural University, Taian, China. Shandong Provincial Key Laboratory of Animal Biotechnology and Disease Control and Prevention, Shandong Agricultural University, Taian, China., Laboratory of Zoonoses, China Animal Health and Epidemiology Center, Qingdao, China., Institute of Immunology, Shandong Agricultural University, Taian, China. 2020.
- Nicola Decaro. HoBi-Like Pestivirus and Reproductive Disorders. Department of Veterinary Medicine, University of Bari Aldo Moro, Valenzano, Italy. 2020
- Pinior B., Garcia S., Minviel J. J., Raboisson D. Epidemiological factors and mitigation measures influencing production losses in cattle due to bovine viral diarrhoea virus infection: A meta-analysis. Transbound. Emerg. Dis. 2019; 66:2426 – 2439.
- Schirrmeier H., Strebelow G., Depner K., Hoffmann B., Beer M. Genetic and antigenic characterization of an atypical pestivirus isolate, a putative member of a novel pestivirus species. J. Gen. Virol. 2004.
- Stalder H., Meier P., Pfaffen G., Wageck-Canal C., Rüfenacht J., Schaller P. et al. Genetic heterogeneity of pestiviruses of ruminants in Switzerland. Prev. Vet. Med. 2005; 72:37 – 41. 10.1016/j.prevetmed.2005
- Victor Riitho, Rebecca Strong, Magdalena Larska, Simon P. Graham and Falko Steinbach Bovine Pestivirus Heterogeneity and Its Potential Impact on Vaccination and Diagnosis Reprinted from. Viruses. 2020; 12:1134. DOI:10.3390/v12101134

