Зайкова О. Н.1,2, Лосич М. А.1,2, Елаков А. Л.1, Верховский О. А.2, Гребенникова Т. В.1, Алипер Т. И.1, Непоклонова И. В.2
1 ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии им. почётного академика Н.Ф. Гамалеи» Минздрава России, г. Москва
2 АНО «Научно-исследовательский институт диагностики и профилактики болезней человека и животных», г. Москва
Аннотация
Проведён филогенетический анализ изолятов вируса бешенства, выделенных от кошек и человека, контактировавшего с кошкой, больной бешенством. На основании сравнительного анализа фрагментов геномов изолятов вируса бешенства выдвинуто предположение об их территориальном распределении. По итогам данной работы и на основании анализа литературных данных установлена роль кошки как важного потенциального звена в передаче вируса бешенства, циркулирующего в дикой природе, человеку.
Ключевые слова: бешенство кошек, эпидемиология бешенства, секвенирование.
Abstract
A phylogenetic analysis of rabies virus isolated from cats and human contacted with a rabid cat was performed. Based on a comparative analysis of fragment of the rabies virus genomes, an assumption is made about territorial distribution of it. According to the results of this work, the role of a cat in the transmission of the wild to humans has been established.
Key words: rabies in cats, rabies epidemiology, sequencing.
Введение
Бешенство (Rabies) — широко распространенная, острая зоонозная нейроинфекция теплокровных животных и человека, протекающая с тяжелым поражением нервной системы и, как правило, заканчивающаяся летальным исходом. Вирус бешенства (ВБ) относится к порядку Mononegavirales, семейству Rhabdoviridae, роду Lyssavirus. Геном ВБ несегментирован и представлен одной молекулой спиралеобразно скрученной негативной РНК и пятью открытыми рамками считывания (ORFs), располагающимися в геноме в следующем порядке: 3’-N-P-M-G-L-5’. В составе вириона ВБ 5 структурных белков: нуклеопротеин (N), фосфопротеин (P), матричный белок (М), гликопротеин (G) и РНК – зависимая РНК полимераза или большой белок (L- large protein). [4,7,8,14,17].
Ежегодно в мире от бешенства погибает около 58 000 человек, причем 90% смертельных случаев отмечают в Юго-Восточной Азии и Африке. Количество случаев заболевания в различных регионах мира определяется комплексом социальных, политических и экономических факторов. В результате возможной экспозиции вирусом приблизительно 10 млн пациентов ежегодно проходит постэкспозиционную профилактику. Большинство жертв в данных регионах – дети младше 15 лет, не получившие постэкспозиционной профилактики после укусов бешеных животных [5].
В Российской Федерации бешенство, почти повсеместно, носит природно-очаговый характер, а основными его источниками и распространителями являются дикие плотоядные животные: лисица, енотовидная собака, волк, корсак, песец. Дикие животные заражают домашних (собак и кошек) и сельскохозяйственных животных, и вместе с ними являются источником инфекции для человека [10-12,22,29].
В природных очагах Российской Федерации циркулируют представители классического бешенства, вид Rabies virus. В результате типирования последовательностей генов нуклеопротеина (гена N) и гликопротеина (гена G) была установлена циркуляция на территории страны 6 филогенетических групп указанного вида: Арктическая; Арктически-подобная; Степная (Евразийская); Центральная (Центрально-Российская); Северо-восточно-европейская; Кавказская [15,16,18].
В 2018 году отмечался незначительный подъем заболеваний животных (2565 случаев) относительно 2016 (2151 случай) и 2017 (2106 случаев) годов. Бешенство животных регистрировали на территориях 68 субъектов Российской Федерации [15].
Несмотря на то, что к бешенству восприимчивы млекопитающие всех видов, основными векторами для вируса являются плотоядные животные. Стойкие природные очаги бешенства в России поддерживаются в первую очередь за счет диких плотоядных (лисица, енотовидная собака и др.), на долю которых приходится около 50% всех регистрируемых в РФ случаев бешенства [8,29].
С ростом количества бездомных, не вакцинированных кошек и собак, появился «городской» тип бешенства. Для оздоровления ситуации в различных городах страны проводятся мероприятия по отлову и стерилизации бездомных кошек и собак с обязательной вакцинацией против бешенства и последующим карантином. Однако их эффективность в ряде случаев остается низкой и не позволяет сдержать рост неконтролируемого увеличения количества безнадзорных животных, при этом точно определить общее число бездомных собак и кошек достаточно сложно. По данным Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, ежегодно в РФ регистрируется более 360 000 обращений людей за антирабической помощью после нападений животных, из них 100 000 обратившихся – дети [1,8,15].
Анализ видовой структуры источников заражения человека, свидетельствует о том, что с 2000 по 2018 гг. людей чаще всего заражали собаки. Удельный вес собак, заразивших людей, в этот период составил 41,5% и достоверно превышал удельный вес других животных, в том числе лисиц. На второе место вышла кошка (17,6%), чего не наблюдалось за всю историю антирабической службы в России (с 1886 г.) и за обозримые в отношении бешенства 480 лет ретроспективного анализа (Сидоров и др., 2016; 2019), хотя еще в 1978 г. М.А. Селимов впервые указал на существенную роль кошек в передаче ВБ из природных в антропургические очаги. Это свидетельствует о более значимой роли кошек как в распространении, так и в качестве потенциального резервуара вируса бешенства, чем ранее предполагалось. Исходя из этого, целью настоящей работы была молекулярно-генетическая характеристика изолятов вируса бешенства, выделенных на территории нашей страны, с последующим изучением особенностей эпизоотического процесса в популяции кошек, определением генетического разнообразия вируса и оценки факторов его передачи [15].
Материалы и методы.
Был проведён сравнительный молекулярно-генетический анализ 44-х изолятов вируса бешенства, выделенных на территории РФ с 1987 по 2016 год от кошек, лис, енотовидных собак, енотов, КРС, собак, песцов, человека, а также 6 вакцинных штаммов: RV-97, SADB19, SAG2, ERA, ERACB-20M, Щёлково 51.
В сравнительных экспериментах был использован изолят ВБ «Shuv» ( «Шувалов»), выделенный С.В. Грибенча из головного мозга человека, укушенного больной кошкой, путём проведения нескольких пассажей вируса бешенства на белых беспородных мышах [6]. арРР
РНК выделяли из 10% суспензии головного мозга с применением коммерческого препарата TRI ® Reagent (Sigma Aldrich) согласно методике, получали кДНК, а затем проводили ПЦР [27].
Олигонуклеотидные праймеры, фланкирующие фрагмент гена N, были разработаны нами самостоятельно (таблица 1):
Таблица 1
Праймеры для проведения двухэтапной ОТ-ПЦР
|
Праймер |
Последовательность |
Позиция в геноме |
|
F2 |
5' – TAACACC (C\T)CTACAATGGA — 3' |
58-75 |
|
R1 |
3' – TACACACGITTAACCTCATG — 5' |
647-666 |
Учёт реакции амплификации проводили с помощью электрофореза в 1% агарозном геле. Образцы очищали из агарозного геля с помощью набора Silica Bead DNA Gel Extraction Kit (Fermentas) согласно инструкции производителя. Сиквенсовую реакцию проводили на амплификаторе ДТ-прайм (ДНК-технология). Затем продукты амплификации переосаждали для последующего секвенирования с использованием автоматического секвенатора Applied Biosystems 3130 Genetic Analyzer.
Для выравнивания нуклеотидных последовательностей и проведения филогенетического анализа применяли пакет программ DNASTAR v 3.12 ( «Lasergenе Inc.», США) и BioEdit 7.0.1. Для оценки достоверности топологии филогенетической дендрограммы был проведен bootstrap-анализ с привлечением 1000 псевдореплик. Эволюционный анализ проводили с использованием программного обеспечения BEAST v 1.10.4 и его компонентов.
Результаты и обсуждение
В результате выравнивания полученных нуклеотидных последовательностей фрагмента гена N была построена филогенетическая дендрограмма и проведён филогенетический анализ (рисунок 1). Размер исследуемого фрагмента составил 468 н.о. (положение в гене 100-567), кодирующих 156 аминокислот.
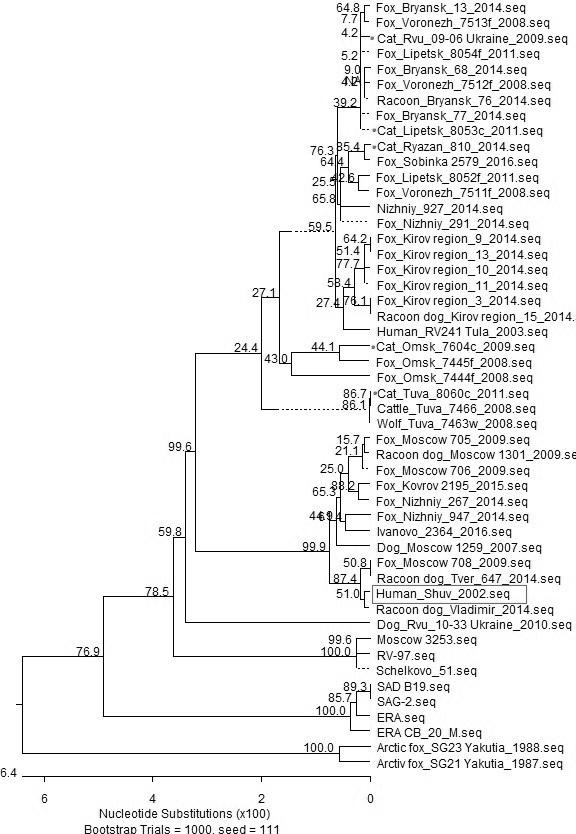
Рисунок 1. Филогенетическая дендрограмма, построенная на основании данных о первичной структуре гена N ВБ с помощью MegAlign 7.1.0 (44). Выравнивание нуклеотидных последовательностей проводили с использованием программы BioEdit7.0.4.1. методом ClustalW.
Анализ показал, что исследуемые изоляты ВБ формируют 3 группы. Установлено, что изолят «Shuv» филогенетически близок изоляту Vladimir 525_2014. Остальные изоляты, выделенные от кошек, образуют вместе с изолятами Евразийской группы ВБ отдельный кластер.
При сравнении фрагментов нуклеопротеина исследуемых изолятов ВБ было установлено, что изолят «Shuv» на заданном участке генома полностью соответствует изоляту Vladimir 525_2014, выделенному от енотовидной собаки. Ранее было установлено, что изоляты ВБ Центральной группы в позиции 95 содержат триптофан вместо лейцина, что также характерно для изолята «Shuv». Таким образом, изолят «Shuv» также относится к Центральной группе вирусов.
Остальные изоляты, выделенные от кошек, можно отнести к Евразийской группе ВБ на основании их молекулярного сродства с представителями этой группы и топологии на филогенетической дендрограмме. Изолят 'Rvu 09-06_Ukraine, выделенный от кошки на территории Украины, отличается молекулярной структурой нуклеопротеина от изолята 'Rvu 10-33_Ukraine примерно на 1,9%, при этом, изолят 'Rvu 10-33_ukraine ранее был охарактеризован как представитель Северо-восточно-европейской группы вирусов [26].
Эволюционный анализ показал, что изоляты Центральной группы, образуя два ответвления на дендрограмме, могли иметь общего предка в 2005-2006 годах. Изолят «Shuv», выделенный в 2002 году и располагающийся на одном ответвлении с изолятами из Владимирской, Тверской и Московской областей (рисунок 2), может являться их общим предшественником.
Изоляты, выделенные от кошек в Липецкой, Рязанской области, Украине на заданном участке генома идентичны изолятам, выделенным от лис, енота, собаки в Липецкой, Воронежской, Владимирской, Брянской и Нижегородской областях. Изоляты Брянской, Воронежской, Липецкой области и Украины в 2002 году могли меть общего предка с изолятами Владимирской, Рязанской и Нижегородской областей. Изолят Rvu 09-06_Ukraine, выделенный от кошки в 2009 году, на эволюционной дендрограмме располагается на одной ветви с изолятом Voronezh 7512f, выделенным в 2008 году от лисы. Вероятно, изолят, выделенный в Воронеже, может являться предшественником вируса, выделенного в Украине от кошки.
Изоляты, выделенные от кошек в Омской области и Респ. Тыва, в позиции 56 фрагмента нуклеопротеина имеют остаток изолейцина вместо валина, что соответствует изолятам, выделенным от КРС, лисы и волка в этих регионах. Однако в позиции 101 изолят, выделенный от кошки в Омской области, соответствует изоляту, выделенному от лисы на данной территории, и содержит аминокислоту серин. Изолят, выделенный от кошки в Респ. Тыва, в данной позиции соответствует изоляту, выделенному от КРС и волка на данной территории, и содержит аспарагин.
Изолят, выделенный в Туле от человека в 2003 году, в 1990-е годы мог иметь общие корни с изолятами, выделенными в Омске (2008-2009 гг.) и Республике Тыва (2008-2011 гг.). В свою очередь, последние в 1992-1996 годах могли иметь общие корни с изолятами, выделенными в Кировской области (2014 г.).
Ранее, с помощью молекулярно-генетических методов, было подтверждено, что причиной гибели людей в 2018 году явились вирусы, распространенные в природных очагах бешенства, активных в регионах проживания погибших, относящиеся к подгруппе степных вирусов (Евразийская группа). Эта группа наиболее широко представлена во многих исследованиях и захватывает большую часть территории нашей страны [15,16,18].
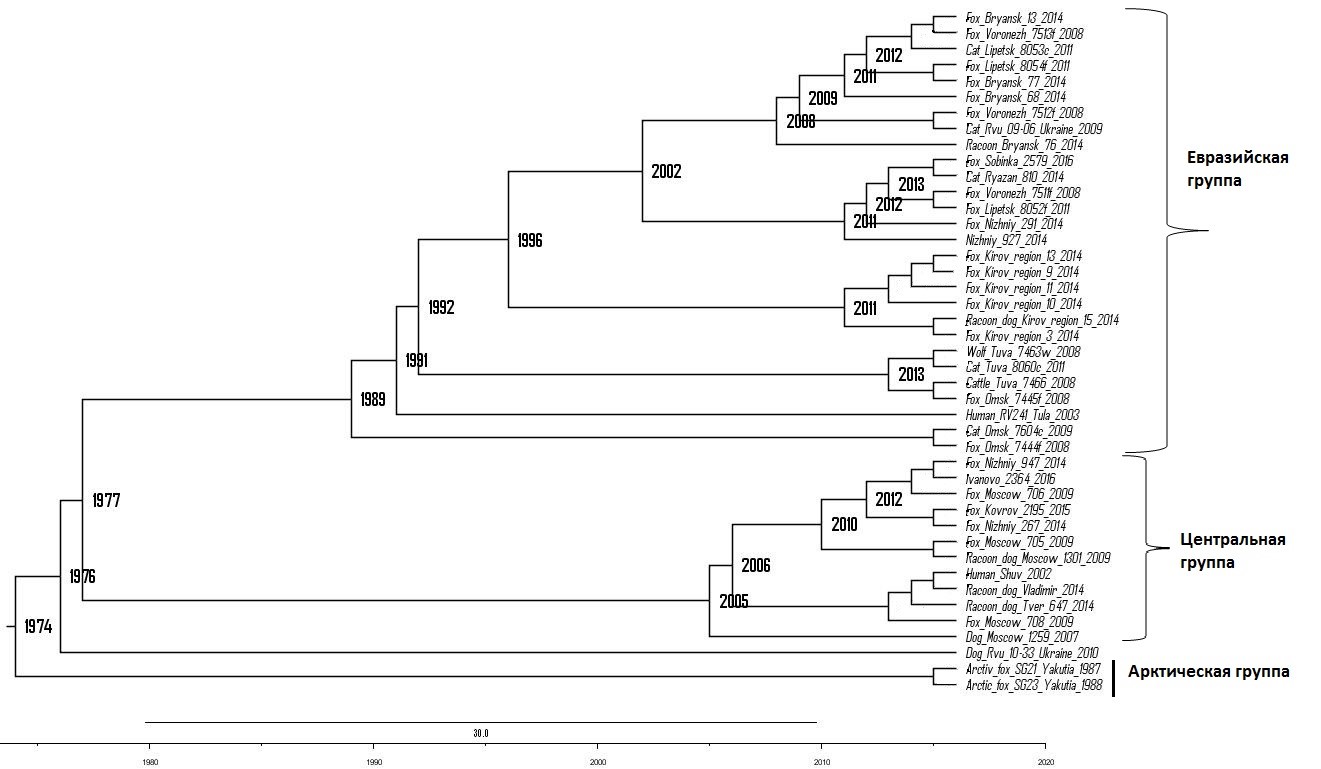
Рисунок 2. Эволюционный анализ изолятов ВБ, выделенных на различных территориях РФ в различные периоды времени
Как показал эволюционный и сравнительный молекулярно-генетический анализ изолятов ВБ, представленных в данной работе, кошка действительно заражается бешенством при контакте с дикими плотоядными и может являться звеном в передаче вируса из популяции в популяцию, а также – человеку.
Известно, что агрессивная кошка способна нанести множественные укусы и глубокие царапины, особую опасность при этом представляют повреждения в области лица, шеи и рук. Основываясь на различиях в условиях обитания, популяции кошек было предложено группировать следующим образом [1]:
1) домашние городские кошки, не покидающие квартир – их численность трудно определить даже предположительно, риск заражения бешенством практически отсутствует;
2) домашние городские кошки, пользующиеся свободным выгулом – осваивают довольно ограниченную территорию, где знают все укрытия и места скопления пищевых отходов, риск заражения не исключается и многократно возрастает при неблагополучии города по бешенству; снижение риска могут обеспечить своевременная профилактическая вакцинация;
3) домашние кошки в сельской местности и на окраинах населённых пунктов — при вольном содержании осваивают значительные территории, очень вероятна возможность контактов с безнадзорными и дикими животными, при этом риск заражения может снизить только профилактическая вакцинация;
4) городские домашние кошки, вывезенные на дачные и садово-огородные участки – риск заражения высок, частое следствие заражения – завоз болезни в города, своевременная профилактическая вакцинация обязательна [1].
Кошки при бешенстве в буйной форме начинают странно или непредсказуемо себя вести. У животных может быть беспокойный, застывший, пугающий или пустой взгляд. Если их запирают в клетки, то кошки начинают совершать беспорядочные активные движения, будто «сметающие» препятствие, и стараются укусить или поцарапать движущиеся предметы. Кроме того, может наблюдаться тремор и слабость, и нарушение координации движений [8,28].
Существуют также особенности формирования поствакцинального антирабического иммунитета у кошек. Так у кошек, в отличие от собак, в подавляющем большинстве случаев, уровень антирабических антител достигает высоких значений даже при однократной вакцинации животных вне зависимости от возраста и породы. При этом интересным является тот факт, что у кошек после многократной вакцинации наблюдается незначительное снижение титра антирабических антител [13].
Результаты исследований Ведерникова В. А. и Балдиной И. В. показали, что случаи бешенства кошек спорадичны и вторичны по отношению к бешенству диких хищников. Они возникают в разное время и в разных местах, то есть, не связаны между собой, а заражение всегда связано с контактом с больными дикими животными [1].
С 2000 года в Российской Федерации осуществляется контроль распространения бешенства в дикой фауне с помощью оральной вакцинации диких плотоядных, для чего повсеместно используются приманки с оральной вакциной, изготовленной на основе штаммов RV-97 или ERAG333 вируса бешенства. При этом во всех неблагополучных по бешенству пунктах и районах к обязательной вакцинации всех домашних собак необходимо добавить проведение вакцинации кошек и сельскохозяйственных животных. Следует осуществлять обязательный контроль содержания домашних животных и предпринимать чрезвычайные меры по изолированию бродячих собак и кошек [9,20,21,24,25].
Заключение
Проведенные нами исследования показали, что кошка может являться потенциальным звеном передачи вируса бешенства из популяции в популяцию, в особенности – передачи вируса бешенства из дикой природы человеку, нанося при этом раны опасной локализации.
Таким образом, выполненные ретроспективные исследования указывают на значимость молекулярно-генетических методов в диагностике бешенства. Филогенетический анализ позволяет конкретизировать генетические подгруппы бешенства, которые явились причиной гибели людей, а также конкретизировать ареал разных подгруппы вируса бешенства, распространенных в России. Возможность участия в эпидемическом процессе лиссавирусов других видов (для России: Irkut, Вирус европейских летучих мышей 1-го типа (EBLV-1), Западно-кавказский лиссавирус летучих мышей (WCBLV), отличных от вида классического вируса бешенства (RABV), делает вероятным отсутствие у зараженных людей и животных проявления типичных клинических признаков болезни и указывает на необходимость исключать эту инфекцию из возможных причин энцефалитов неясной этиологии [2,3,19,23,]. В случае гибели людей или животных от острой нейроинфекции неясной этиологии, наступившей в пределах 10 суток после заболевания (в 80% случаев смерть человека при бешенстве наступает в течение 10 суток), секционный материал рекомендуется направлять для лабораторного исследования на лиссавирусы.
На сегодняшний день единственным надежным средством профилактики бешенства является вакцинация, в том числе оральная иммунизация диких плотоядных. Однако для успешного проведения антирабических мероприятий необходимо не только проводить и контролировать оральную иммунизацию в дикой природе, но и проводить своевременную вакцинацию домашних и бродячих животных с обязательным контролем антирабического иммунитета.
Список литературы
- Балдина И. В., Эпизоотологические основы совершенствования профилактики бешенства в Московском регионе// автореферат диссертации, 2004
- Ботвинкин А. Д., Смертельные случаи заболевания людей бешенством в Евразии после контактов с рукокрылыми. (Обзор литературы)//Plecotus et al. 14 (2011): 75–86
- Ботвинкин А. Д., Кузьмин И. В., Хисматуллина Н. А., Итоги изучения антигенного разнообразия вируса бешенства на территории бывшего СССР // Ветеринарная патология. № 3. 2004, С. 117-127
- Васильев Д. А., Луговцев В. Ю., ред. Вирусы, вызывающие болезни общие для многих видов сельскохозяйственных животных. Курс лекций по вирусологии. Часть вторая. Ульяновск; 2004.
- Всемирная организация здравоохранения. Availableat: http://www.who.int/ru.
- Грибенча С. В., Козлов А. Ю., Костина Л. В., Елаков А. Л., Лосич М. А., Цибезов В. В., Забережный А. Д., Алипер Т. И., Получение моноклональных антител к нуклеопротеину вируса бешенства//Вопросы вирусологии, 2013,Том 58, №5, С. 38-43
- Груздев, К. Н. Бешенство животных: практическое руководство / К. Н. Груздев, В. В. Недосеков – М.: Аквариум ЛТД, 2001. – 304с
- Диагностика и профилактика инфекционных болезней собак и кошек: Руководство для практикующих ветеринарных врачей/ Под ред. профессора Алипера Т. И.- М.: Издательство «ЗооВетКнига», 2017.-304, С. 52-64
- Елаков А. Л., Уласов В. И., Баньковский Д. О., Сафонов Г. А. Изучение биологических свойств штамма ERA G333 вируса бешенства // Ветеринария. 2011. № 2. С. 22 – 25.
- Елаков А. Л., Зайкова О. Н., Кочергин-Никитский К. С., Гребенникова Т. В., Алипер Т. И. Мониторинг бешенства у диких животных в Брянской области. Ветеринария. 2015; (1): 11-4.
- Зайкова О. Н., Гребенникова Т. В., Елаков А. Л., Кочергин-Никитский К. С., Алипер Т. И., Чучалин С. Ф., Гулюкин А. М. Молекулярно-генетическая характеристика геномов полевых изолятов вируса бешенства, циркулирующих на территории Кировской области. Вопросы вирусологии. 2016; 61 (4)
- Зайкова О. Н., Гребенникова Т. В., Гулюкин А. М., Шабейкин А. А., Полякова И. В., Метлин А. Е., Молекулярно-генетическая характеристика полевых изолятов вируса бешенства, выявленных на территории Владимирской, Московской, Тверской, Нижегородской и Рязанской областей// Вопросы вирусологии, Издательство «Медицина», Москва, — Т. 62, №3, 2017, С. 101-108
- Мухин А. Н., Раев С. А., Лосич М. А., Зайкова О. Н., Остапчук О. В., Непоклонова И. В., Верховский О. А., Алипер Т. И., Длительность и напряженность антирабического иммунитета у кошек после вакцинации вакциной «РАБИФЕЛ»/ Ветеринария и кормление. 2018. № 6. С. 37-39. 10.30917/ATT-VK-1814-9588-2018-6-15
- Международный комитет по таксономии вирусов/ http://www.ictvonline.org/virustaxonomy.asp
- Полещук Е. М., Сидоров Г. Н., Нашатырева Д. Н., Градобоева Е. А., Пакскина Н. Д., Попова И. В., Бешенство в Российской Федерации: информационно-аналитический бюллетень. – Омск: Издательский центр КАН, 2019. – 110 с.
- Полещук Е. М., Сидоров Г. Н., Грибенча С. В., Итоги изучения антигенного и генетического разнообразия вируса бешенства в популяциях наземных млекопитающих России //Вопросы вирусологии, №3, т. 58, 2013. С. 9-16
- Руководство по вирусологии: Вирусы и вирусные инфекции человека и животных / Под ред. Академика РАН Д. К. Львова. – М.:ООО «Издательство „Медицинское информационное агентство“, 2013. – 1200 с.
- Чупин С. А., Чернышова Е. В., Метлин А. Е. Генетическая характеристика полевых изолятов вируса бешенства, выявленных на территории Российской Федерации в период 2008-2011 гг. Вопросы вирусологии. 2013; (4): 44-9.
- Alexandr D. Botvinkin, Elena M. Poleschuk, Ivan V. Kuzmin, Tatyana I. Borisova, Suren V. Gazaryan, Pamela Yager,and Charles E. Rupprecht, Novel Lyssaviruses Isolated from Bats in Russia // Emerging Infectious Diseases, Vol. 9, No. 12, 2003. Р. 1623-1625
- Barbara Forró a, Szilvia Marton a, Sándor Kecskeméti b, Ákos Hornyák c,1, Krisztián Bányai, Vaccine-associated rabies in red fox, Hungary// Vaccine 37 (2019) 3535–3538
- Fehlner-Gardiner C., Nardine-Davis S., Armstrong J. Et al. ERA vaccine-derived cases of rabies in wildlife and domestic animals in Ontario, Canada, 1989 – 2004 // Journal of Wildlife Diseases. 2008. 44 (1). P. 71 – 85.
- Hampson K, Coudeville L, limbo T, Sambo M, Kieffer A, Attlan M, et al, Estimating the Global Burden of Endemic Canine Rabies// PLos Negi Trop Dis 9 (94): e0003709. Doi: 10.1371/journal. Pntd.0003709
- Ivan V. Kuzmin, Lillian A. Orciari, Yohko T. Arai, Jean S. Smith, Cathleen A. Hanlon,Yosuke Kameoka, Charles E. Rupprecht, Bat lyssaviruses (Aravan and Khujand) from Central Asia: phylogenetic relationships according to N, P and G gene sequences // Virus Research 97 (2003) 65–79
- Müller T., Bätza H.J., Beckert A., Bunzenthal C. Et al. Analysis of vaccine-virus-associated rabies cases in red foxes (Vulpes vulpes) after oral rabies vaccination campaigns in Germany and Austria // Arch Virol. 2009. 154 (7): 1081 – 1091.
- Metlin A., Paulin L., Suomalainen S., Neuvonen E., Rybakov S., Mikhalishin V. Et al. Characterization of Russian rabies virus vaccine strain RV-97. Virus Res. 2008; 132 (1-2): 242-7.
- Metlin A. E., Rybakov S., Gruzdev K., Neuvonen E., Huovilainen A. Genetic heterogeneity of Russian, Estonian and Finnish field rabies viruses. Arch. Virol. 2007; 152 (9): 1645-54.
- OIE Manual of diagnostic Tests and Vaccines for Terrestrial Animals (mammals, birds and bees), 2018
- Rabies in cats / Advisory Board on Cat Deseases // 2008
- Shulpin M. I., Nazarov N. A., Chupin S. A., Korennoy F. I., Metlin A. Ye., Mischenko A. V., Rabies surveillance in the Russian Federation//Rev.Sci. Tech. Off. Int. Epiz., 2018, 37 (2), 483-495. Doi: 10.20506/rst.37.2.2817

