В статье представлены данные по влиянию колострального иммунитета к цирковирусу свиней второго типа на формирование поствакцинального иммунитета. В опыте были использованы клинически здоровые поросята не содержащие ЦВС-2 в переферической крови. На основании различий в уровне IgG-антител животные были разделены на 4 опытные и одну контрольную группы. ля иммунизации была использована производственная серия вакцины «ВЕРРЕС-ЦИРКО». Ля контрольного заражения был использован изолят «ТМ-2014» ЦВС-2 ранее выделенный нами на культуре клеток альвеолярных макрофагов свиней от поросенка с СПМИ. Инфекционная активность вируса составляла104,0 TCID50/см³. Вакцинация серопозитивных поросят не индуцировала выработку IgM-антител, а сразу приводила к увеличению уровня IgG-антител, что обычно характерно для вторичного иммунного ответа. При вакцинации серонегативных животных наблюдали классическую картину с появлением ранних IgM-антител и далее, после изотипического переключения – вирусспецифических IgG-антител. Аналогичный результат получили после экспериментального заражения поросят. Постинфекционные IgM-антитела синтезировались только у изначально серонегативного молодняка или у поросят после полного исчезновения колостральных антител. Контакт с вирусом на фоне специфических IgG-антител приводил только к изменению их количественного содержания. Несмотря на наличие материнских антител, уровень сероконверсии у привитых животных не отличался от такового у особей с низким уровнем антител до вакцинации. Серологическое обследование поголовья на наличие или отсутствие IgM-, IgG-антител имеет важное значение для прогнозирования течения и исхода цирковирусной болезни свиней и является эффективным средством ее ранней диагностики.
Цирковирусные болезни свиней (ЦВБС) – одна из основных проблем промышленного свиноводства, они характеризуется разнообразием клинических признаков, значительной степенью распространенности и высокой летальностью. Наиболее характерной для ЦВБС является субклиническая форма инфекции, негативный эффект ее сводится к снижению производственных показателей: сохранности, среднесуточного прироста массы тела поросят, коэффициента конверсии корма. Возбудитель ЦВБС – цирковирус свиней 2 типа (ЦВС-2), относится к роду Circovirus семейства Circoviridae, представляет собой ДНК-содержащий безоболочечный вирус небольшого размера (16 – 20 нм), капсид которого состоит из одного белка, кодируемого открытой рамкой считывания 2 (ORF-2). Впервые связь ЦВС-2 с патологией свиней была показана в середине 90-х годов XX в. после выделения возбудителя от поросенка с синдромом послеотъемного мультисистемного истощения (СПМИ), а уже к 2004 г. во Франции была изготовлена коммерческая вакцина на основе инактивированного ЦВС-2. В настоящее время в мире существует несколько эффективных рекомбинантных субъединичных вакцин против ЦВБС на основе ORF-2, в том числе и отечественная – »ВЕРРЕС-ЦИРКО» [4, 5].
Несмотря на то что механизмы иммунной защиты против ЦВБС не до конца установлены, а поствакцинальный иммунитет – нестерильный, профилактическую вакцинацию против ЦВБС широко используют в промышленном свиноводстве, например, в ряде стран, иммунизируют 100% всего восприимчивого поголовья. Производители вакцин рекомендуют различные схемы иммунизации, предусматривающие как вакцинацию поросят с 2-недельного возраста, так свиноматок и хряков. Иммунизация супоросных свиноматок приводит к созданию пассивного (лактогенного) иммунитета у новорожденных поросят, причем срок циркуляции колостральных антител в крови колеблется от 2 до 15 недель [13]. Таким образом, пассивная передача антител к ЦВС-2 способствует тому, что к моменту вакцинации большая часть поросят серопозитивна в отношении ЦВС-2. Это вызывает ряд вопросов, связанных с влиянием колостральных антител на эффективность применяемой вакцины и в дальнейшем на формирование напряженного поствакцинального иммунитета. Так, в работе M. Fort et al. приведены данные о том, что у поросят с высоким титром колостральных антител, гуморальный иммунный ответ после вакцинации был незначительным, в то время как у особей с низким титром такого эффекта не наблюдали [12]. Однако, исследования T. Opriessnig et al. показали, что наличие материнских антител не влияет на пролиферацию ЦВС-2-специфических γ-интерферон-секретирующих клеток после вакцинации [15]. Кроме того, существует достаточно противоречивая информация о взаимосвязи между уровнем антител к ЦВС-2 и восприимчивостью животных к заражению. Одни исследователи считают этот факт установленным, другие – не обнаружили корреляции между уровнем антител после вакцинации и последующей защитой поросят от инфицирования [3, 16, 20].
Основная роль при формировании системного иммунитета принадлежит антителам, относящимся к IgG-изотипу и большинство работ, посвященных ЦВБС, основано на их тестировании. Вместе с тем на фоне значительного числа серопозитивных животных в свиноводческих хозяйствах большое практическое значение имеет дифференциация IgM- и IgG-специфических антител к ЦВС-2, позволяющая своевременно выявлять первично зараженных животных, прогнозировать развитие эпизоотической ситуации и эффективность вакцинопрофилактики [8, 14].
Цель настоящей работы – оценить влияние колостральных антител на антигенную активность рекомбинантной субъединичной вакцины против ЦВБС «ВЕРРЕС-ЦИРКО» и распределение вирусспецифических IgM- и IgG-антител в гуморальном иммунном ответе.
Материалы и методы. Эксперименты проводили в Вышневолоцком отделе ФГБУ ВИЭВ им. Я.Р. Коваленко. В опыте использовали клинически здоровых 21-дневных поросят, полученных из свиноводческого хозяйства промышленного типа. Предварительно их тестировали на наличие цирковируса свиней второго типа и антител к нему методами ПЦР и ИФА соответственно. По результатам ИФА отобрали животных с высоким уровнем колостральных антител (IgG-изотипа) к ЦВС-2 и серонегативных особей. Из них по принципу аналогов сформировали четыре опытных и одну контрольную группу по 6 голов в каждой. В первую и третью опытные группы вошли серопозитивные поросята, во вторую, четвертую и пятую (контрольную) – серонегативные.
ЦВС-2 выявляли при помощи «тест-системы для обнаружения ЦВС-2 методом ПЦР» ( «ВЕТБИОХИМ»). Постановку реакции, учет и интерпретацию полученных результатов проводили согласно инструкции по применению, рекомендованной фирмой-производителем.
Для тестирования антител класса G к ЦВС-2 использовали тест-систему «ЦИРКО-СЕРОТЕСТ», а класса M – набор для выявления антител IgM класса к цирковирусу свиней 2 типа иммуноферментным методом «ЦВС-IgM СЕРОТЕСТ» ( «ВЕТБИОХИМ»). Реакцию ставили, результаты учитывали и интерпретировали согласно инструкции фирмы-производителя.
Поросят первой и второй групп иммунизировали производственной серией вакцины «ВЕРРЕС-ЦИРКО» (ООО «Ветбиохим»), согласно инструкции в дозе 1 см3; особям третьей – пятой – вводили внутримышечно 1 см3 ФСБ (0,01 М фосфатный буфер, 170 mM NaCl, pH 7,4). На 35-е сутки провели контрольное заражение животных первой – четвертой групп в дозе 2 см3 внутримышечно и 3 см3 интраназально (табл.1). Пробы крови отбирали у всех животных опытных и контрольной групп в динамике на 0-, 14-, 28-, 35-, 49- и 61-е сутки эксперимента.
Таблица 1
Схема опыта на поросятах
|
Группа |
Серологический статус до опыта |
Вакцинация против ЦВБС (0 сутки) |
Заражение ЦВС-2 (35-е сутки) |
|
Первая |
Серопозитивные |
+ |
+ |
|
Вторая |
Серонегативные |
+ |
+ |
|
Третья |
Серопозитивные |
– |
+ |
|
Четвертая |
Серонегативные |
– |
+ |
|
Пятая (контрольная) |
Серонегативные |
– |
– |
Для контрольного заражения использовали изолят «ТМ-2014» ЦВС-2, который ранее был выделен нами от поросенка с СПМИ с использованием альвеолярных макрофагов свиней. Вирус культивировали на перевиваемой культуре клеток почки свиньи PK-15 свободной от ЦВС-1. Инфекционная активность его составляла 104,0 TCID50/см3.
Данные статистически обрабатывали общепринятыми методами с применением компьютерных программ Microsoft office Excel 2003, Stat Plus 2005.
Результаты исследований и обсуждение. Из данных эксперимента по выявлению вирусспецифических IgM-антител, представленных в таблице 2, видно, что наличие колостральных IgG-антител в сыворотке крови поросят не позволяет иммунной системе синтезировать поствакцинальные антитела, относящиеся к IgM-изотипу (первая группа).
Таблица 2
Динамика выявления IgM-антител к ЦВС-2 в сыворотке крови поросят
|
Группа |
Время исследования, сут |
|||||
|
О |
14 |
28 |
35 |
49 |
61 |
|
|
Первая |
– |
– |
– |
– |
– |
– |
|
Вторая |
– |
+ |
+ |
– |
– |
– |
|
Третья |
– |
– |
– |
– |
+ |
+ |
|
Четвертая |
– |
– |
– |
– |
+ |
+ |
|
Пятая (контрольная) |
– |
– |
– |
– |
– |
– |
В то же время у серонегативного молодняка второй группы IgM-антитела к ЦВС-2 зарегистрировали на 14-е сутки после вакцинации, а у особей третьей и четвертой групп их выявили на 14-е сутки после экспериментального заражения. Анализ полученных данных свидетельствует о том, что циркуляция поствакцинальных и постинфекционных IgM-антител к ЦВС-2 продолжалась в организме подопытных поросят, по меньшей мере, в течение двух недель после первого обнаружения.
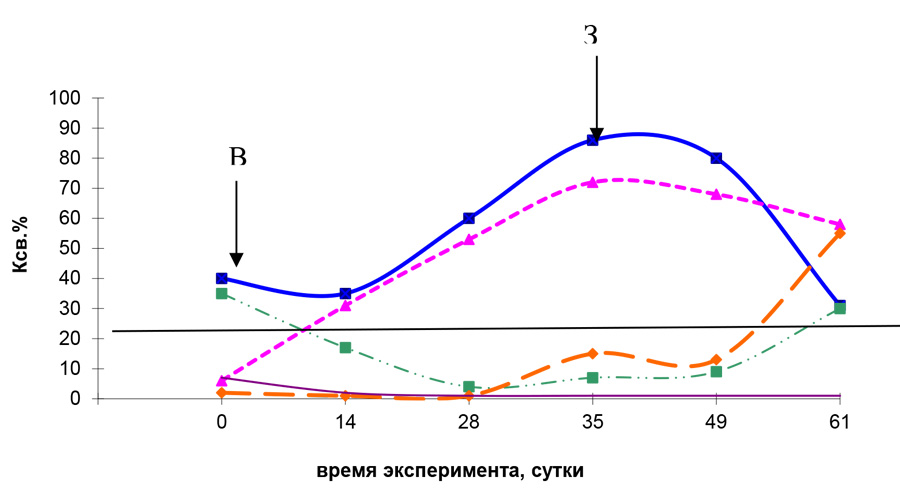
Тестирование вирусспецифических IgG-антител показало, что в процессе поствакцинального иммуногенеза происходит их выраженный синтез, как у изначально серопозитивных (первая группа), так и у серонегативных (вторая группа) животных (рис.). У поросят этих групп установили достоверное увеличение IgG-антител на 28-е сутки (P < 0,01), а максимальный их уровень – на 35-е сутки после введения вакцины. При этом в среднем по группе, уровень IgG-антител у молодняка с колостральными антителами был несколько выше, по сравнению с таковыми без антител до вакцинации. В эти же сроки произошла полная элиминация колостральных IgG-антител у не вакцинированных особей (третья группа).
После экспериментального заражения у всех вакцинированных животных отмечали снижение содержания IgG-антител к ЦВС-2, которое обусловлено их участием в иммунологических реакциях, направленных на элиминацию вируса. При этом статистически достоверные изменения установлены у поросят первой группы на 61-е сутки проведения эксперимента (P <0,01). У не вакцинированного молодняка третьей и четвертой групп, в эти же сроки (на 26-е сутки после экспериментального заражения), уровень постинфекционных IgG-антител к ЦВС-2 был сопоставим с показателями у животных первой и второй групп.
У экспериментально зараженных поросят через 26 суток после этого на фоне выявления ДНК ЦВС-2 в крови методом ПЦР видимых клинических признаков ЦВБС (срок наблюдения) не наблюдали.
В настоящее время в странах с развитым свиноводством широко применяют вакцины против данного комплекса заболеваний. Многочисленные исследования показали, что иммунизация способна снизить как горизонтальное, так и вертикальное распространение вируса, хотя и не приводит к формированию стерильного иммунитета [9]. В этой связи к вакцинам для супоросных свиноматок и подсосных поросят предъявляют повышенные требования, особенно к основным ее компонентам (структура и количество антигена, адъювант), поскольку присутствие колостральных антител в крови у 2 – 3-недельного молодняка непосредственно перед вакцинацией может препятствовать формированию активного иммунного ответа. В нашем эксперименте колостральные IgG-антитела сохранялись у поросят в течение 1 месяца после рождения, учитывая их 21-суточный возраст на момент формирования опытных групп.
Сопоставление данных иммунизации серонегативных и серопозитивных животных вакциной «ВЕРРЕС-ЦИРКО» показало, что наличие или отсутствие колостральных IgG-антител к ЦВС-2 до вакцинации не оказывало негативного влияния на последующую антигенную активность препарата. Этот вывод полностью согласуется с результатами исследований по оценке эффективности аналогичной вакцины зарубежного производства. В своей работе авторы показали, что в группе поросят с самым высоким уровнем материнских антител после вакцинации против ЦВБС падеж был многократно ниже, чем среди не привитых животных (контрольная группа) [3].
Нами установлены различия в механизме формирования гуморального иммунного ответа к ЦВС-2. Так, вакцинация серопозитивных поросят не индуцировала выработку IgM-антител, а сразу приводила к увеличению уровня IgG-антител, что обычно характерно для вторичного иммунного ответа (первая группа). При вакцинации серонегативных животных наблюдали классическую картину с появлением ранних IgM-антител и далее, после изотипического переключения – вирусспецифических IgG-антител (вторая группа). Аналогичный результат получили после экспериментального заражения поросят. Постинфекционные IgM-антитела синтезировались только у изначально серонегативного молодняка (четвертая группа) или у поросят после полного исчезновения колостральных антител (третья группа). Контакт с вирусом на фоне специфических IgG-антител приводил только к изменению их количественного содержания.
Отсутствие клинических признаков при наличии ЦВС-2 в периферической крови – хорошо изученный феномен. Развитие клинических форм болезни в подавляющем большинстве случаев связано с наличием других патогенов: парвовируса свиней, вируса репродуктивно-респираторного синдрома свиней, Mycoplasma hyopneumoniae и других [17].
До последнего времени комплексная диагностика ЦВБС включала ПЦР для обнаружения ДНК ЦВС-2 и ИФА для выявления вирусспецифических антител IgG-изотипа. Однако вакцинация не препятствует инфицированию животных, а наличие положительного результата ПЦР не свидетельствует об активном инфекционном процессе [20]. На тестировании IgG-антител основана ретроспективная диагностика болезни, фиксирующая достаточно отдаленный по времени контакт с возбудителем. В этой связи выявление ранних IgM-антител является дополнительным эффективным методом диагностики ЦВБС, поскольку они первыми образуются при контакте с чужеродным антигеном и представляют основной пул антител при первичном иммунном ответе. Уже в 80-х годах XX в. с развитием технологии получения моноклональных антител появилась возможность дифференцировать спектр антител в противовирусном иммунном ответе человека и животных [7, 11, 18, 21]. Однако коммерческие тест-системы подобной направленности в ветеринарии появились сравнительно недавно и далеко не ко всем вирусным патогенам. Так в отношении ЦВС-2 в Европейских странах для дифференциации вирусспецифических IgM- и IgG-антител у домашних свиней и диких кабанов используется ИФА-набор производства компании Ingenasa (Испания), аналогичный по направленности набор разработан и в нашей стране [1, 2, 6, 10, 19].
В практическом плане полученные нами результаты по выявлению IgM-антител к ЦВС-2 у серонегативных животных в свиноводческих хозяйствах являются маркерным показателем недавнего (10 – 20 суток) заноса возбудителя в стадо и однозначно свидетельствуют об инфекционном процессе в организме. При наличии антител обоих изотипов можно говорить о более поздних сроках контакта с вирусом – до 5 недель. Следовательно, перед применением вакцин в хозяйстве ветеринарным специалистам можно рекомендовать проводить выборочное серологическое обследование поголовья на наличие или отсутствие IgM-, IgG-антител для объективного анализа эпизоотической ситуации и последующей оценки эффективности специфической профилактики ЦВБС.
Заключение. Наличие колостральных IgG-антител к цирковирусу свиней 2 типа не ингибирует поствакцинальный противовирусный иммунный ответ и впоследствии не препятствует формированию иммунитета к цирковирусной болезни свиней. Дифференциальное выявление IgM- и IgG-антител к ЦВС-2 в сыворотке крови свиней имеет важное значение для свиноводческих хозяйств при прогнозировании течения и исхода цирковирусной инфекции и является эффективным средством ее ранней диагностики.
Благодарность. Авторы статьи выражают глубокую благодарность сотрудникам Вышневолоцкого отдела ФГБНУ Всероссийский научно-исследовательский институт экспериментальной ветеринарии им. Я.Р. Коваленко за оказание научно-методической помощи в организации проведения исследований.
Литература
- Арутюнова М. А., Цибезов В. В., Раев С. А., Мусиенко М. И., Алексеев К. П., Верховский О. А., Алипер Т. И. Иммуноферментный метод выявления специфических антител классов IgG и IgM к цирковирусу свиней второго типа (ЦВС-2). Ветеринария. 2014; 8: 55 – 59.
- Козлов А. Ю., Костина Л.В, Алексеев К. П., Арутюнова М.А, Терехова Ю. О., Цибезов В. В., Алипер Т. И., Верховский О. А. Получение моноклональных антител к цирковирусу свиней второго типа (ЦВС-2) и их применение для диагностики цирковирусной инфекции. Российский ветеринарный журнал. 2013; 2:2 – 22.
- Кукушкин С. А. Методы оценки эффективности вакцинации свиней против респираторных болезней // www.piginfo.ru
- Орлянкин Б. Г. Цирковирусные болезни свиней: Распространение, диагностика и специфическая профилактика. Ветеринария. 2013; 8:3 – 8.
- Раев С. А., Алексеев К. П., Шемельков Е. В., Алипер Т. И., Мусиенко М. И., Орлянкин Б. Г., Мишин А. М., Верховский О. А., Забережный А. Д. Разработка и применение вакцины «ВЕРРЕС-ЦИРКО». Ветеринария сегодня. 2013; 3 (6): 54 – 59.
- Шкаева М. А., Богданова В. С., Цибезов В. В., Гибадулин Р. А., Мусиенко М. И., Алексеев К. П., Гребенникова Т. В., Верховский О. А., Забережный А. Д., Алипер Т. И. Иммуноферментный метод выявления антител к цирковирусу второго типа (ЦВС-2) с применением рекомбинантного капсидного белка ОРФ-2. Вопросы вирусологии. 2005; 51 (5): 44 – 48.
- Brocchi E., Berlinzani A., Gamba D., De Simone F. Development of two monoclonal antibody- based ELISAs for the detection of antibodies and the identification of swine isotypes against swine vesicular disease virus. J. Virol. Meth. 1995; 52: 155 – 167.
- Carasova P., Celer V., Takacova K. et al. The levels of PCV2 specific antibodies and viremia in pigs. Research in Veterinary Science. 2007; 83 (2): 274 – 278.
- Chae C. et al. Commercial porcine circovirus type 2 vaccines: Efficacy and clinical application. Veterinary Journal. 2012; 194: 151 – 157.
- Csank T., Pist J., Polláková J., Holoda E., Harvan M. Prevalence of porcine circovirus 2 infection in pig population in Slovakia. Acta Virol. 2011; 55 (3): 267 – 271.
- Forgani B., Myoraku C. K., Schmidt N. J. Production of monoclonal antibodies to human IgM for assay of viral IgM antibodies. J. Virol. Meth. 1982; 5: 317 – 327.
- Fort M., Sibila M., Pérez-Martín E.M. et al. One dose of a porcine circovirus 2 (PCV2) subunit vaccine administered to 3-week-old conventional piglets elicits cell-mediated immunity and significantly reduces PCV2 viremia in an experimental mode. Vaccine. 2009; 27: 4031 – 4037.
- Gerber P. F., Garrocho F. M., Lana A. M., et al. Serum antibodies and shedding of infectious porcine circovirus 2 into colostrum and milk of vaccinated and unvaccinated naturally infected sows. Vet. J. 2008; 188 (2): 240 – 242.
- Meerts P., Misinzo G., Lefebvre D. et al. Correlation between the presence of neutralizing antibodies against porcine circovirus 2 (PCV2) and protection against replication of the virus and development of PCV2-associated disease. BMC Vet. Res. 2006; 30 (2): 6.
- Opriessnig T., Patterson A. R., Elsener J. et al. Influence of maternal antibodies on efficacy of porcine circovirus type 2 (PCV2) vaccination to protect pigs from experimental infection with PCV2. Clin. Vaccine Immunol. 2008; 15 (3): 397 – 401.
- Opriessnig T., Yu S., Thacker E. L. et al. Derivation of porcine circovirus type 2-negative pigs from positive breeding herds. J. Swine Health Prod. 2004; 12:186 – 191.
- Pallares F. J., Halbur P. G., Opriessnig T. et al. Porcine circovirus type 2 (PCV-2) coinfections in US field cases of postweaning multisystemic wasting syndrome (PMWS). J. Vet. Diagn. Invest. 2002; 14 (6):515 – 519.
- Paul
P.S. - Sattler T., Sailer E., Wodak E., Schmoll F. Serological detection of emerging viral infections in wild boars from different hunting regions of Southern Germany. Tierarztl Prax Ausg G Grosstiere Nutztiere. 2012; 40 (1):27 – 32.
- Segales J., Allan G. M., Domingo M. Porcine circoviruses. Diseases of Swine, 10-th edition, Wiley-Blackwell. 2012; 405 – 417.
- Van Zaan D., Ijzerman J. Monoclonal antibodies against bovine immunoglobulins and their use in isotype specific ELISA for rotavirus antibodies. J. Immunol. Meth. 1984; 72:444.