Вирусы распространены на Земле повсеместно. Они являются неклеточными формами жизни, способными размножаться в клетках прокариот (безъядерные организмы) и эукариот (ядерные организмы), используя их биосинтетический аппарат. В настоящее время известен 2321 вирус позвоночных, беспозвоночных, простейших, растений, грибов, водорослей, бактерий и архей, из которых 2284 агента классифицированы и распределены в 349 родов, 19 подсемейств, 87 семейств и 6 порядков [20].
Иммунная система обеспечивает врожденный (естественный) и адаптивный (приобретенный) иммунитет, который защищает организмы от вирусов, бактерий, грибов, паразитов, измененных и погибших клеток [5, 8, 12]. Предполагают, что врожденный иммунитет возник примерно 1,5 млрд. лет назад. Им обладают все многоклеточные организмы. Система его основана на распознавании компонентов патогенов: липополисахаридов, липопептидов, пептидогликанов, нуклеиновых кислот, флагеллина и профилина. Эти консервативные структуры называют молекулярными «образами» (паттернами) патогенности. Клетки, обеспечивающие врожденный иммунитет, обладают паттерн-распознающими рецепторами (ПРР), благодаря которым осуществляются распознавание и фагоцитоз патогенов [9, 11, 19]. Факторы врожденного иммунитета не специфичны в отношении антигенов. Они включаются в защиту сразу после преодоления возбудителем кожи или слизистых оболочек, эффективно действуют в течение 4 суток и не способны сохранять память о первичном контакте с агентом [16, 17].
К клеткам, обеспечивающим врожденный противовирусный иммунитет, относятся естественные киллеры, моноциты, макрофаги и дендритные клетки. Естественные киллеры − лимфоидные клетки, составляющие 5 – 15% лимфоцитов крови. Они имеют общего лимфоидного предшественника и развиваются в костном мозге. Важную роль в их созревании играют ретикулярные клетки стромы, образующие цитокины. Зрелые естественные киллеры покидают костный мозг и мигрируют во вторичные лимфоидные органы (печень, селезенку, кишечник и лимфатические узлы), ориентируясь по градиенту хемокинов, распознаваемых специфическими рецепторами [5, 15].
Моноциты циркулируют в крови и составляют 5 – 10% лейкоцитов. В течение 1 – 2 суток они переходят в ткани, превращаясь в макрофаги, продолжительность жизни которых составляет месяцы и даже годы. Моноциты и макрофаги формируют мононуклеарную фагоцитирующую систему [12].
Выделяют 2 основные формы макрофагов – резидентные и воспалительные. Первые образуются в результате спонтанной миграции моноцитов из кровотока в ткани, а вторые – в процессе экстренного перехода из крови в очаги воспаления. Воспалительные макрофаги обладают высокой фагоцитарной и бактерицидной активностью, являясь эффекторными (исполнительными) клетками врожденного иммунитета. Резидентные макрофаги выполняют в основном гомеостатическую и регуляторную функции, а также выступают в роли антиген-представляющих клеток (АПК).
Большинство резидентных макрофагов имеют специальные обозначения: в печени их называют клетками Купфера, в костях – остеокластами, в легких – перитонеальными, а в почках – мезангиальными клетками [5, 7, 12].
Дендритные клетки занимают особое место среди факторов врожденного иммунитета. Они являются самыми мощными антиген-представляющими клетками и основным связующим звеном врожденного и адаптивного иммунитета. Только они способны индуцировать первичный адаптивный иммунный ответ [8, 12]. Свое название (dendron – дерево) эти клеточные элементы получили из-за характерной морфологии – наличия многочисленных длинных и подвижных цитоплазматических отростков, которые образуются в процессе активации и дифференцировки. Важную роль в физиологии дендритных клеток играют Тoll-подобные рецепторы, способные распознавать практически все основные патогены, включая бактерии, вирусы, грибы, простейших и паразитов [12, 17].
Рецепторы вирусных нуклеиновых кислот. Основным механизмом обнаружения системой врожденного иммунитета вирусных инфекций является идентификация вирусных нуклеиновых кислот рецепторами, расположенными в эндосомах и лизосомах, а также цитозоле клеток. Вслед за этим включаются гуморальные и клеточные факторы врожденного иммунитета – первой линии защиты организма [5, 17].
Вирусные нуклеиновые кислоты распознаются с помощью Toll-, RIG- и NOD-подобных рецепторов. TLR − трансмембранные белки, N-концевая последовательность которых обогащена лейцином и выявляет патогенные паттерны на поверхности патогенов, а также нуклеиновые кислоты вирусов. У мышей обнаружили 11 TLR (1 – 7, 9, 11 – 13), у человека −10 (1 – 10). В клеточных эндосомах и лизосомах локализуются TLR-3, -7, -8, -9, распознающие вирусные нуклеиновые кислоты. Остальные TLR расположены на поверхности клеток и идентифицируют бактерии, грибы и простейших [2, 12].
TLR, реагирующие на вирусные нуклеиновые кислоты, синтезируются на мембранах эндоплазматического ретикулума и с помощью клеточного белка UNC-93В транспортируются в эндосомы, где активируются протеазами. Цитоплазматический домен TLR взаимодействует с адапторными молекулами сигнальных путей и приводит к активации различных генов, в том числе обеспечивающих синтез интерферонов I типа и провоспалительных цитокинов [14, 15].
У человека и мыши TLR-3 выявили в разных клетках, включая фибробласты, В-лимфоциты, лимфоидные дендритные и эпителиальные клетки. В плазмоцитоидных дендритных клетках он не образуется. После взаимодействия с лигандом (вирусной двунитевой РНК) происходят конформационные изменения N-концевой части рецептора, передающиеся на внутриклеточный домен TIR. В передаче сигнала участвует адапторный белок TRIF, запускающий экспрессию генов интерферона-β (ИФН-β).
TLR-7 обнаружили в плазмоцитоидных дендритных клетках и В-лимфоцитах, а TLR-8 – в миелоидных дендритных клетках и моноцитах. TLR-7 и TLR-8 имеют аналогичный сигнальный путь (через адапторный белок MyD88). В результате каскада ферментативных реакций активируется транскрипционный фактор IRF-7 и индуцируется экспрессия генов интерферонов I типа. TLR-7 и TLR-8 взаимодействуют с однонитевыми вирусными РНК.
TLR-9 экспрессируется в плазмоцитоидных дендритных клетках и В-лимфоцитах. Он взаимодействует в эндосомах с двунитевыми ДНК вирусов простого герпеса 1 и 2 [15].
В неструктурированной части клеток (цитозоле) локализованы рецепторы 2 семейств: RLR и NLR. К первому из них относятся рецепторы RIG-I и MDA-5, которые состоят из С-концевого РНК-хеликазного, ответственного за распознавание вирусных РНК, и двух N-концевых сигнальных доменов. RIG-I идентифицирует однонитевые вирусные РНК, несущие на 5’-конце трифосфат и обогащенные на протяжении более 23 нуклеотидов уридином и аденозином. Этот рецептор также распознает короткие двунитевые РНК без 5’-трифосфата. Рецептор RIG-I выявляет РНК вирусов гриппа, японского энцефалита, везикулярного стоматита, Сендай и гепатита С [2, 15].
Рецептор MDA-5 реагирует на длинные (около 2000 пар нуклеотидов) двунитевые РНК, образующиеся при репликации пикорнавирусов. Геномная РНК реовирусов, состоящая из разных по длине фрагментов двунитевой РНК, распознается обоими рецепторами (RIG-I и MDA-5). RLR при контактах с вирусной РНК индуцируют синтез интерферонов I типа.
Представители семейства NLR состоят из 3 доменов: сигнального N-концевого, олигомеризационного центрального и С-концевого, ответственного за узнавание РНК вируса гриппа, ДНК аденовируса и вируса вакцины. NLR при встрече с вирусными нуклеиновыми кислотами активируют превращение неактивной прокаспазы-1 в активный фермент. Активированная каспаза расщепляет молекулы-предшественники ИЛ-1β и ИЛ-18 с образованием зрелых цитокинов, секретируемых клеткой [12, 15].
Гуморальные факторы врожденного противовирусного иммунитета представлены в основном интерферонами I и III типов, которые продуцируются через несколько часов после инфицирования. К ИФН I типа, обладающих выраженной противовирусной активностью, относят ИФН-&alpha, ИФН-&beta, ИФН-κ и ИФН-ω. Они представляют собой небольшие белковые молекулы, скрепленные дисульфидной связью. Гомология аминокислотной последовательности среди ИФН I типа составляет 30 – 60%. Ранее предполагалось, что ИФН-α синтезируется преимущественно лейкоцитами, а ИФН-β – фибробластами. Однако оказалось, что при соответствующей индукции эти ИФН могут продуцировать различные типы клеток [4, 5, 12].
ИФН-ω сходен по структуре с ИФН-α/β и является главным компонентом человеческого лейкоцитарного ИФН, обладающего мощной антивирусной активностью в отношении различных ДНК- и РНК-содержащих вирусов. ИФН-κ синтезируется в неактивированных кератиноцитах и участвует в защите от различных вирусов, хотя уровень его противовирусной активности относительно ниже, чем других ИФН I типа. Биологическая активность ИФН видоспецифична.
Основными продуцентами ИФН являются плазмоцитоидные дендритные клетки. При вирусных инфекциях они образуют в 200 – 1000 раз больше ИФН-α и ИФН-&beta, чем другие клетки крови. Вирусы стимулируют синтез ИФН I типа у всех эукариотов [5, 12].
ИФН III типа – новое семейство цитокинов, они структурно сходны с ИФН I типа и белками семейства интерлейкинов-10 (ИЛ-10). Три представителя нового семейства цитокинов называют ИФН-λ1 (ИЛ-29), ИФН- λ2 (ИЛ-28А) и ИФН-λ3 (ИЛ-28В). Аминокислотная последовательность ИФН-λ и ИФН-α идентична на 15 – 19% [10].
Образование ИФН III типа наиболее выражено при инфекциях, вызываемых вирусами с однонитевой РНК. Однако, вирусы с двунитевыми ДНК и РНК также способны индуцировать их синтез.
ИФН I и III типов (особенно первые) обладают противовирусной активностью. Полагают, что ИФН I типа играют важную роль в системном противовирусном иммунитете, а ИФН III типа являются ключевыми факторами местного противовирусного иммунитета.
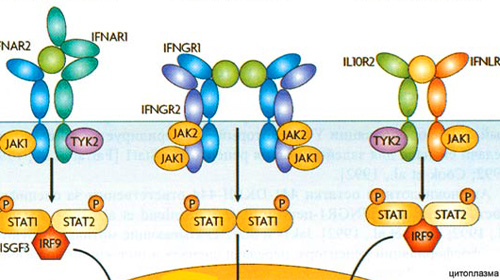
Основными индукторами ИФН служат 1- и 2-нитевые вирусные РНК, действующие через TLR эндолизосом [16, 17]. Такая локализация TLR имеет важный биологический смысл. В этих органеллах происходит «раздевание» и деградация вирусов, без чего невозможен контакт их нуклеиновых кислот с рецепторами. В эндолизосомах клеточные ДНК и РНК отсутствуют, а их появление свидетельствует об инфицировании клеток вирусами. При некрозе клеток или нарушениях апоптоза клеточные нуклеиновые кислоты поступают в эндолизосомы, что может вести к развитию аутоиммунных заболеваний. После взаимодействия TLR с вирусными нуклеиновыми кислотами возникают сигналы, передаваемые через адапторные белки интерфероновым регуляторным факторам, которые транспортируются в ядро и запускают транскрипцию генов, ответственных за синтез ИФН. Последние взаимодействуют со специфическими клеточными рецепторами и активируют гены, продукты которых участвуют в защите от вирусов [5, 13]. Рецептор для ИФН I типа состоит из молекул IFNAR1 и IFNAR2 длиной соответственно 530 и 315 аминокислотных остатков (рис. 1). На каждой клетке имеется по 200 – 6000 таких рецепторов. С ними ассоциированы 2 тирозинканазы (TYK2 и JAK1) семейства Janus, которые фосфорилируют внутриклеточные участки рецептора. Связывание IFNAR1- и IFNAR2-цепей рецептора молекулой ИФН вызывает их димеризацию и активацию TYK2 и JAK1, которые фосфорилируют транскрипционные факторы STAT1 и STAT2. Гетеродимер STAT1/STAT2 соединяется с интерфероновым регуляторным фактором 9, проникает в ядро, взаимодействует с регуляторной последовательностью ISRE и индуцирует транскрипцию более 300 ИФН-зависимых генов. Часть их кодируют белки, обладающие противовирусной активностью.
Рецептор для ИФН III типа состоит из двух белковых цепей – IFNLR1 и IL10R2 (общий с рецептором ИЛ-10). Молекула ИФН III типа взаимодействует с обеими цепями рецептора, образуя 3-компонентный комплекс, передающий сигнал в клетку [12, 13].
Противовирусное действие ИФН реализуется активацией различных защитных факторов в неинфицированных клетках. Наиболее изученными из них являются протеинкиназа R, 2’-5’-олигоаденилатсинтетаза и белки Мх (рис. 2). Протеинкиназа R (серинтреониновая киназа) образуется во всех клетках в небольшом количестве. Под влиянием ИФН синтез протеинкиназы R резко возрастает, но она не обладает активностью, поскольку является проферментом. Протеинкиназа R взаимодействует с двунитевой вирусной РНК и активируется. Затем она фосфорилирует α-субъединицу эукариотического инициирующего фактора трансляции 2α (eIF2α), и он теряет свою активность. В результате блокируется синтез вирусных белков. Кроме того, протеинкиназа R индуцирует апоптоз зараженных клеток. Мыши с дефектным геном протеинкиназы R проявляют повышенную чувствительность к заражению рабдо-, ортомиксо- и ортобуньявирусами [3, 18].
Другой механизм противовирусного действия ИФН связан с активацией генов, кодирующих 2’-5’-олигоаденилатсинтетазу. Этот фермент обеспечивает полимеризацию аденозинтрифосфатов с образованием 2’-5’-олигоаденилатов. Последние связываются неактивной мономерной рибонуклеазой L, стимулируя формирование гомодимера, способного расщеплять однонитевые вирусные РНК. Мыши с дефектным геном рибонуклеазы L обладают повышенной чувствительностью к заражению пикорна-, рео-, тога-, парамиксо-, ортомиксо-, флави- и ретровирусами.
Третий путь реализации противовирусного действия ИФН связан с активацией синтеза белков Мх, относящихся к диаминам и проявляющим активность гуанозинтрифосфатазы. Они участвуют в защите от ортомиксо-, парамиксо-, рабдо-, тога- и буньявирусов [12, 15].
Существуют и другие, менее изученные механизмы ИФН-индуцированной защиты от вирусов, в частности белки, кодируемые ИФН-стимулированными генами семейств ISG15, ISG 56 и P200. ИФН-индуцированные белки тетхерин и виперин препятствуют размножению ортомиксо-, альфа-, ретро- и аренавирусов.
ИФН-ω в некоторых случаях превосходит по антивирусной активности ИФН-α и ИФН-β. Он является мощным ингибитором репликации вируса иммунодефицита человека. ИФН-α и ИФН-β активируют макрофаги и естественные киллеры, стимулируют экспрессию молекул МНС-I и МНС-II на поверхности клеток. Регулируют синтез ИФН-α и ИФН-β сами ИФН I типа посредством позитивной обратной связи. Это позволяет усиливать иммунный ответ против тех вирусов, которые являются слабыми индукторами ИФН [5, 13].
ИФН-γ (II тип) первоначально синтезируется естественными киллерами в период врожденного иммунного ответа, а также Т – лимфоцитами и другими клетками во время адаптивного иммунного ответа. Рецептор ИФН-γ отличается от таковых ИФН I и III типов. Он состоит из 4 белковых цепей (2 гетеродимеров IFNGR1 и IFNGR2), не взаимодействующих между собой (рис. 1). В результате связывания димера ИФН-γ с 2 гетеродимерами рецептора активируются тирозинкиназы JAK1 и JAK2. Эти ферменты фосфорилируют транскрипционный фактор STAT1, который димеризуется и мигрирует в ядро, где взаимодействует с участком GAS и инициирует транскрипцию ИФН-зависимых генов. Всего при действии ИФН-γ в клетках активируется свыше 200 генов [13]. Основными мишенями для ИФН-γ в период врожденного иммунитета являются моноциты и макрофаги. Последние продуцируют активные формы кислорода и азота, которые разрушают вирусы в фаголизосомах.
Противовирусной активностью обладает комплемент. Однако он не является главным фактором защиты против вирусов, поскольку многие из них ускользают от его действия. Например, герпесвирусы и вирусы оспы синтезируют белки, которые сходны с клеточными ингибиторными белками системы комплемента. Некоторые вирусы для проникновения в клетки используют рецепторы и мембранные регуляторные белки комплемента [3, 5].
Вирусы могут разрушаться внутри клеток в процессе аутофагии – заключения их внутри вакуолей. Эти вакуоли, сливаясь с лизосомами, образуют аутофаголизосомы, в которых вирусы разрушаются ферментами.
К основным клеточным факторам врожденного противовирусного иммунитета относятся естественные киллеры, дендритные клетки и макрофаги.
Естественные киллеры способны обнаруживать и уничтожать зараженные вирусами клетки и продуцировать гамма-интерферон (ИФН- γ), индуцирующий остальные противовирусные механизмы. На их поверхности имеются активирующие и ингибирующие рецепторы. Лиганды последних постоянно формируются на нормальных незараженных клетках. Важнейшими ингибирующими лигандами являются молекулы МНС-I, которые имеются практически на всех ядросодержащих клетках. Лиганды активирующих рецепторов на поверхности интактных клеток отсутствуют или образуются в небольшом количестве, но их число резко возрастает при вирусных инфекциях и стрессе [1, 5].
Механизмы взаимодействия естественных киллеров с нормальными и инфицированными клетками различаются. На первых естественные киллеры распознают молекулы МНС-I – лиганды ингибирующих рецепторов. В инфицированных вирусами клетках резко снижается или прекращается образование МНС-I. Клетки, на поверхности которых отсутствуют «свои» молекулы МНС-I, разрушаются естественными киллерами путем контактного цитолиза с помощью перфорина и гранзимов. Существует обратная корреляция между интенсивностью экспрессии МНС-I и разрушением инфицированных вирусом клеток естественными киллерами. В условиях стресса в клетках интенсивно образуются активирующие лиганды, которые отменяют ингибирующий эффект МНС-I, в результате чего клетка-мишень лизируется. В стимуляции естественных киллеров главную роль играют ИФН-&alpha, ИФН-β и интерлейкин (ИЛ) 12.
В очаге инфекции активированные естественные киллеры быстро размножаются. Под влиянием ИЛ-15 происходит пролиферация практически всех их субпопуляций. Замедление пролиферации естественных киллеров совпадает с развитием адаптивного иммунного ответа. Возможно, активированные Т-лимфоциты продуцируют цитокины, регулирующие данный процесс.
Дендритные клетки (Лангерганса, миелоидные и плазмоцитоидные) происходят от кроветворных стволовых клеток и проходят несколько стадий развития. Незрелые дендритные клетки циркулируют в крови и составляют менее 0,5% лейкоцитов. Не достигнув зрелости, они мигрируют в ткани, где их подразделяют на резидентные и воспалительные. Первые присутствуют в основном в барьерных тканях (коже и слизистых оболочках), вторые − в очагах воспаления. После созревания дендритные клетки концентрируются преимущественно в Т-зонах региональных лимфатических узлов [15, 16]. Только незрелые дендритные клетки проявляют фагоцитарную активность, но они плохо представляют антиген и слабо активируют Т-лимфоциты. Созревание дендритных клеток сопровождается синтезом протеолитических ферментов, расщепляющих вирусные белки на пептиды, которые представляются МНС-I.
Основную часть плазмоцитоидных дендритных клеткок составляют предендритные клетки, являющиеся основными продуцентами ИФН I типа при вирусных инфекциях. Зрелые плазмоцитоидные дендритные клетки интенсивно экспрессируют молекулы МНС и костимуляции, но прекращают секретировать ИФН I типа. Плазмоцитоидные дендритные клетки играют двойную роль в иммунной системе: на предендритной стадии являются важнейшим компонентом врожденного противовирусного иммунитета, а в зрелом состоянии активируют Т-лимфоциты.
Макрофаги экспрессируют на мембране 9 семейств рецепторов, участвующих во взаимодействии с поврежденными клетками и микроорганизмами. Распознавание антигенов макрофагами сопровождается изменением экспрессии поверхностных молекул, усилением фагоцитарной активности и продукцией цитокинов. Они способны продуцировать и секретировать свыше 100 различных молекул. Большинство из них являются индуцибельными. Важнейшие продукты секреции макрофагов – воспалительные (ИЛ-1&beta, ИЛ-6, ИЛ-12, ИЛ-18, ФНО-&alpha, ГМ-КСФ) и противовоспалительные (ИЛ-10, ТФР-β) цитокины, а также ряд хемокинов. ИФН-γ служит основным активатором макрофагов.
Активированные макрофаги убивают инфицированные клетки, фагоцитируют их и вирусы, а также образуют противовирусные факторы – ИФН-&gamma, фактор некроза опухолей α (ФНО- α) и окись азота. В фаголизосомах вирусы разрушаются посредством кислородзависимых (активные формы кислорода и галоидсодержащие соединения) и кислороднезависимых (локальное закисление, бактерицидные пептиды, катионные белки, ферменты) механизмов [3, 5, 6].
Пути преодоления вирусами защитных механизмов врожденного иммунитета. В процессе длительной эволюции вирусы приобрели способность противодействовать механизмам врожденного иммунитета посредством различных стратегий.
Подавлять синтез ИФН могут продукты многих вирусных генов. Продукт открытой рамки считывания С вируса гепатита В ингибирует индукцию образования ИФН-β. Матриксный белок вируса везикулярного стоматита препятствует транскрипции промотора ИФН-β (участка ДНК, ответственного за связывание РНК-полимеразы). Вирус африканской чумы свиней, размножающийся в макрофагах, подавляет синтез ИФН-γ и ФНО- α. Онкопротеин Е6 вируса папилломы человека 16 блокирует транскрипционную функцию ИФН-регуляторного фактора 3 (IRF-3). В присутствии онкопротеина Е6 вирус Сендай не индуцирует образование ИФН-β. Герпесвирус человека типа 8 кодирует аналог клеточных ИФН-регуляторных факторов. Интерференция продуктов транскрипции вирусов с последними блокирует экспрессию ИФН [15, 19].
Блокировка передачи сигнала. Цитомегаловирус, аденовирусы, многие парамиксовирусы, вирусы Эбола, полиомы мышей и везикулярного стоматита и ряд других агентов способны подавлять передачу активирующего сигнала после взаимодействия ИФН с рецептором на поверхности клетки [5, 15].
Нарушение функций ИФН-индуцированных белков. Многие вирусы подавляют функции ИФН-индуцированных белков. Вирус энцефаломиокардита разрушает связь 2'-5'–олигоаденилатов с рибонуклеазой L, в результате чего вирусная РНК не расщепляется. Аналоги 2'-5'–олигоаденилатов, препятствующие активации рибонуклеазы L, синтезируются в клетках, инфицированных вирусом простого герпеса и SV40.
Наиболее часто ИФН-индуцированная защита от вирусов опосредована активацией протеинкиназы R двунитевой вирусной РНК. В клетках, зараженных аденовирусами, синтезируется большое количество низкомолекулярной вирусассоциированной РНК (VAI), которая связывается с протеинкиназой R, но не обладает активирующей способностью. Аналогично действуют РНК вируса Эпштейна-Барр и ТАR РНК вируса иммунодефицита человека 1. Белки Е3L вируса вакцины, NS1 вируса гриппа и сигма 3 реовируса предотвращают активацию протеинкиназы R двунитевой РНК. Механизмы деградации протеинкиназы R полиовирусом и вирусом иммунодефицита человека не известны. Вирус гепатита С кодирует 2 белка, интерферирующие с протеинкиназой R. Белок US11 вируса простого герпеса 1 и белок NS1 вируса гриппа блокируют активацию протеинкиназы R двунитевой РНК. Эти белки непосредственно связываются с протеинкиназой R [15, 16].
Другие механизмы. В составе генома вирусов оспы есть гены, продукты которых могут подавлять или изменять иммунный ответ хозяина. Белок Т2 защищает инфицированные вирусом клетки от антивирусного действия фактора некроза опухолей. Белок МТ-7 вируса миксомы служит «ловушкой» для ИФН и ряда хемокинов. Вирус вакцины кодирует гомолог рецептора для ИФН-α и ИФН-&beta, который связывает ИФН I типа. Клетки, инфицированные вирусом Танапокс, секретируют белок, инактивирующий ИФН-&gamma, ИЛ-2 и ИЛ-5. Белок МТ-2 вируса миксомы гомологичен клеточному рецептору для фактора некроза опухолей. Захват данного фактора ведет к блокировке передачи сигнала через функциональный клеточный рецептор. Некоторые вирусы (цитомегаловирусы, вирусы оспы) имеют гены, ответственные за синтез белков, гомологичным хемокинам или их рецепторам. В растворимой форме они выполняют функцию антагонистов естественных хемокиновых рецепторов [15, 19].
Заключение. Врожденный иммунитет основан на распознавании различных молекул патогенов и уничтожении их посредством фагоцитоза. Защита от вирусов происходит в результате подавления размножения их интерферонами и разрушения инфицированных клеток естественными киллерами и макрофагами. В процессе эволюции вирусы приобрели способность противодействовать механизмам врожденного иммунитета.
Литература
- Абакушина Е. В., Кузьмина Е. Г., Коваленко Е. И. Основные свойства и функции NK-клеток человека. Иммунология. 2012; 4:220 – 225.
- Ковальчук Л. В., Хорева М. В., Никонова А. С. Рецепторы врожденного иммунитета (NLR, RLR и CLR). Журнмикробиолог. 2011; 1:93 – 100.
- Мейл Д.; Бростофф Дж., Рот Д. Б., Ройтт А. Иммунология. М.: «Логосфера», 2007;568 с.
- Носик Н. Н., Косякова Н. П. Противовирусный иммунитет. Руководство по вирусологии. Вирусы и вирусные инфекции человека и животных. Под ред. Д.К. Львова. М.: МИА, 2013;370 – 383.
- Орлянкин Б. Г., Непоклонов Е. А., Алипер Т. И. Основы противовирусного иммунитета. М.: ЗооВетКнига, 2015;356 с.
- Пинегин Б. В., Карсонова М. И. Макрофаги: свойства и функции. Иммунология. 2009; 4:241 – 249.
- Сергеев В. А., Непоклонов Е. А., Алипер Т. И. Противовирусный иммунитет. Вирусы и вирусные вакцины. М.: Библионика, 2007;119 – 176.
- Хаитов Р. М. Иммунология: структура и функции иммунной системы. М.: ГЭОТАР-Медиа, 2013; 280 с.
- Хаитов Р. М., Пащенков М. В., Пинегин Б. В. Роль паттернраспознающих рецепторов во врожденном и адаптивном иммунитете. Иммунология. 2009; 1:66 – 76.
- Хаитов М. Р., Шиловский И. П., Хаитов Р. М. Интерфероны третьего типа. Успехи соврем. биол. 2010; 2:147 – 153.
- Черешнев В. А., Шмагель К. В. Иммунология. М.: НП ЦСП, 2014;520 с.
- Ярилин А. А. Иммунология. М.: ГЭОТАР-Медиа, 2010;752 с.
- Borden E. C., Sen G. C., Uze G. et al. Interferons at age 50: past, current and future impact on biomedicine. Nature Rev. Drug Discov. 2007; 6: 975 – 990.
- Coico R., Sunshine G. Immunology-6th ed. Wiley-Blackwell. 2009; 391 p.
- Iwasaki A., Medzhitov R. Innate responses to viral infections. 6th ed. In: Fields Virology. Knipe D. M., Howley P. M. (Ed.). Philadelphia, 2013; 1:189 – 213.
- Male D., Brostoff J., Roth D., Roitt I. Immunology. 8th ed. Elsevier, 2013;472 p.
- Murphy K. Janeway’s Immunobiology. 8th ed. London-N.Y., 2012;868 p.
- Sadler A. J., Williams B. R. Structure and function of the protein kinase R. Curr. Top. Microbiol. Immunol. 2007; 316:253 – 292.
- Tizard I. R. Veterinary Immunology. 9th ed. Elsevier, 2013;551 p.
- Virus Taxonomy. Ninth Report of the International Committee on Taxonomy of Viruses. King A. M.Q.. Adams M. J., Carstens E. B., Lefkowitz E. J. (Eds.). Elsevier Academic Press, 2012;1327 p.