Виктория Васильевна Стаффорд, cтарший научный сотрудник, fgnssbeq.i.i@tznvy.pbz
Сергей Алексеевич Раев, к.в.н., ведущий научный сотрудник
Константин Петрович Алексеев, к.б.н., старший научный сотрудник
Антон Геннадиевич Южаков, к.б.н., старший научный сотрудник
Тарас Иванович Алипер, д.б.н., профессор, заведующий лабораторией
Алексей Дмитриевич Забережный, д.б.н., профессор, заведующий лабораторией
Михаил Иванович Гулюкин, д.в.н., профессор, академик РАН, директор
ФГБНУ Всероссийский научно-исследовательский институт экспериментальной ветеринарии имени Я.Р. Коваленко
Олег Анатольевич Верховский, д.б.н., профессор, президент
АНО «Научно-исследовательский институт диагностики и профилактики болезней человека и животных»
Инфекционная патология респираторных органов свиней, наносит огромный экономический ущерб всем странах с развитым свиноводством. В хозяйствах, неблагополучных по репродуктивно-респираторному синдрому (РРСС), инфицированность поросят колеблется от 30 – 40 до 70 – 80%, а летальность при этом может достигать 100%. Наиболее подвержены заболеваниям поросята 2 – 3-месячного возраста. Возбудитель РРСС – небольшой оболочечный РНК-содержащий вирус, относящийся к семейству Arteriviridae. Инфекционный РНК-геном состоит из около 15 тыс. пар нуклеотидов, заключенных в белковый капсид, окруженный липидосодержащей оболочкой, состоящей из нескольких структурных белков. Вирус представлен 2 генотипами: Европейским (генотип 1) и Американским (генотип 2) с различиями в геноме до 44%. В настоящий момент оба генотипа выявляют в Северной Америке, Европе и странах Азии [12].
В России заболевание впервые было отмечено в 1991 г. в Курской области [5]. В настоящий момент Европейский генотип вируса представлен тремя подгруппами (1, 2, 3) [9]. Американский генотип возбудителя был выделен в 2007 г. во время вспышки РРСС в Иркутской области [3].
При первичном контакте восприимчивых животных с вирулентным вирусом РРСС наблюдают развитие яркое выраженных клинических признаков как репродуктивного (аборты, рождение нежизнеспособного потомства), так и респираторного характера (высокая температура, учащенное поверхностное дыхание, посинение кожи в области живота, ушей и конечностей, отказ откорма и задержка в развитии) [6, 12].
Хроническая форма РРСС возникает вследствие адаптации популяции свиней к циркулирующему вирусу, ввиду наличия гомологичного иммунитета. Клинически ее регистрируют в основном у поросят с низким иммунным статусом и в большей степени она связана с проявлением патогенности группы возбудителей вторичных инфекций [4].
В настоящее время для дифференциальной диагностики РРСС используют молекулярно-биологические и иммунохимические методы, основными из них являются полимеразная цепная реакция (ПЦР) и иммуноферментный анализ (ИФА) [1, 4]. Вместе с тем, согласно рекомендациям Всемирной организации здоровья животных (OIE), важную роль для подтверждения клинических случаев заболевания РРСС играет иммуногистохимический метод (ИГХ) [10, 11]. Разработанный в 1941 г. A.H. Coons [7], ИГХ на сегодняшний день занимает одно из главных мест в патоморфологических исследованиях. Его широко используют в научных разработках и в повседневной практической деятельности специалисты-морфологи. ИГХ исследования крайне необходимы, а иногда и обязательны для дифференциальной диагностики инфекционных болезней животных и человека. Они позволяют определить тропизм возбудителя к клеткам, патогенез заболевания и установить обратимость патологического процесса. Основными реагентами, используемыми в ИГХ, являются специфические антитела. При этом применение моноклональных антител (МАТ), к выявляемому патогену, значительно повышает специфичность метода. В частности, ИГХ с использованием МАТ к структурному белку vр72 вируса африканской чумы свиней эффективен для определения локализации вируса в различных органах и тканях инфицированных животных, характеристики особенностей его репродукции и свойств, выделенных изолятов вируса [2]. Метод, обладая высокой чувствительностью и специфичностью, особенно результативен при вирусоносительстве и субклинической форме заболевания, то есть в тех случаях, когда патологические состояния организма трудно определить и тяжело дифференцировать.
Цель наших экспериментов – разработка ИГХ на основе моноклональных антител к капсидному белку (N) вируса РРСС и определение локализации вируса в органах экспериментально зараженных свиней.
Материалы и методы. Экспериментальное заражение поросят провели на Вышневолоцкой опытной базе ВИЭВ о. Лисий. Для этого использовали клинически здоровых 21-суточных поросят, полученных из свиноводческого хозяйства промышленного типа, свободного от вируса РРСС. Для выполнения эксперимента сформировали опытную и контрольную группы по 10 животных в каждой. Молодняк опытной группы инфицировали штаммом Lelystad вируса РРСС с инфекционной активностью lg 5,0 ТЦД50/см3 в дозе 3 см3 интратрахеально и 2 см3 внутримышечно. Животным контрольной вводили незараженную культуру клеток MARK-145 в том же объеме. Поросят содержали в раздельных боксах на протяжении 14 суток, ежедневно наблюдая за их клиническим состоянием. Пробы крови у животных отбирали каждые 48 ч в течение всего периода наблюдения, а внутренних органов для последующего патоморфологического исследования, включая ИГХ, – после проведения эвтаназии всего подопытного и контрольного молодняка.
Полученную сыворотку крови исследовали на наличие генома вируса РРСС методом ПЦР с помощью соответствующей тест-системы согласно рекомендациям производителя ( «Ветбиохим», Россия). При положительном результате ПЦР определяли инфекционную активность вируса в культуре клеток альвеолярных макрофагов свиней (АМС). Для этого клетки АМС засевали в 96-луночные культуральные планшеты (Costar, США) в концентрации 1х105клеток/лунка. Далее готовили десятикратное (от 10-1 до 10-6) разведение вируса, вносили каждое из них в 4 лунки планшета в объеме 100 мкл и инкубировали 4 – 5 суток в атмосфере 5% СО2 при 37 0С. В контроле клеток объем вируса заменяли ростовой средой. Накопление вируса РРСС оценивали методом микроскопии по его цитопатическому действию (ЦПД), инфекционный титр вычисляли по методу Рида и Менча и выражали в lg ТЦД50/см3. IgG к вирусу РРСС в сыворотке крови выявляли в ИФА с помощью набора «РРСС- Серотест плюс» ( «Ветбиохим», Россия). Постановку реакции, учет и интерпретацию полученных результатов проводили согласно инструкции по применению, рекомендованной фирмой-производителем.
ИГХ исследования выполняли в секторе патоморфологии ВИЭВ. В качестве специфических реагентов использовали МАТ 4h7h9 к капсидному белку (N) вируса РРСС, ранее полученные и иммунохимически охарактеризованные в АНО «НИИ ДПБ». Материалом для исследований служили бронхиальные лимфатические узлы и легкие (размер 1,0х1,0х0,5 см), помещенные в 10%-ный раствор забуференного нейтрального формалина. Их выдерживали 48 – 72 ч при комнатной температуре, затем выполняли гистологическую проводку в автоматическом режиме с пропитыванием ткани парафином и дальнейшим формированием блоков. После этого делали срезы толщиной 3 микрона, которые наклеивали на предметные стекла, покрытые глицериновым альбумином по Малори, и высушивали. Полученные препараты 20 мин депарафинировали и 10 мин дегидрировали, отмывали в 2 порциях дистиллированной воды по 5 мин в каждой. Для удаления эндогенной пероксидазы, препараты на 40 мин помещали в 3%-ный раствор перекиси водорода при 37 0С, затем трижды по 10 минут отмывали в фосфатно-солевом буфере рН 7,7 (ФСБ) при комнатной температуре и 40 мин инкубировали в 5%-ном растворе сухого обезжиренного молока на ФСБ при 37 0С. После промывки препаратов их 80 мин инкубировали с МАТ 4h7h9 (в разведении 1:1500 в ФСБ) во влажной камере при 37 0С и отмывали в ФСБ трижды по 10 мин при комнатной температуре. Затем наносили МАТ к IgG мышей, конъюгированные с пероксидазой хрена, в разведении 1:200 в 5%-ном растворе сухого обезжиренного молока на ФСБ, и 40 мин инкубировали во влажной камере при 37 0С. Далее отмывали в ФСБ с твином-50 трижды по 10 мин при комнатной температуре. Непосредственно перед использованием, готовили субстрат пероксидазы: 5мл 0,02М Na-фосфатный буфер рН 5,0; 300 мкл маточного раствора [0,02 г 3-амино-9-этилкарбазола (АЭК) в 3 мл диметилформамида (ДМФ)] и 1мкл 3%-ного раствора перекиси водорода. Срезы инкубировали 20 – 30 мин так же во влажной камере при 37 0С. Затем отмывали в трех порциях дистиллированной воды и окрашивали гематоксилином Майера для лучшей визуализации клеток, параллельно для сравнительной оценки приготовили серию срезов без докрашивания. Статистическую обработку результатов проводили общепринятыми методами с использованием компьютерных программ Microsoft Office Excel 2003, Stat Plus 2005.
Результаты исследований и обсуждение. В течение 6 – 8 суток после заражения поросят штаммом Lelystad вируса РРСС у них наблюдали лишь небольшое снижение аппетита и вялость. В сыворотке крови вирус РРСС обнаружили на 2-е сутки после инфицирования методом ПЦР, а вирусспецифические IgG-антитела в ИФА – на 9-е сутки. Максимальный титр накопления возбудителя в сыворотке крови зафиксировали на 8-е сутки после заражения (102,5 ТЦД50/см3), он оставался таким без достоверных изменений до окончания периода наблюдения (рис. 1).
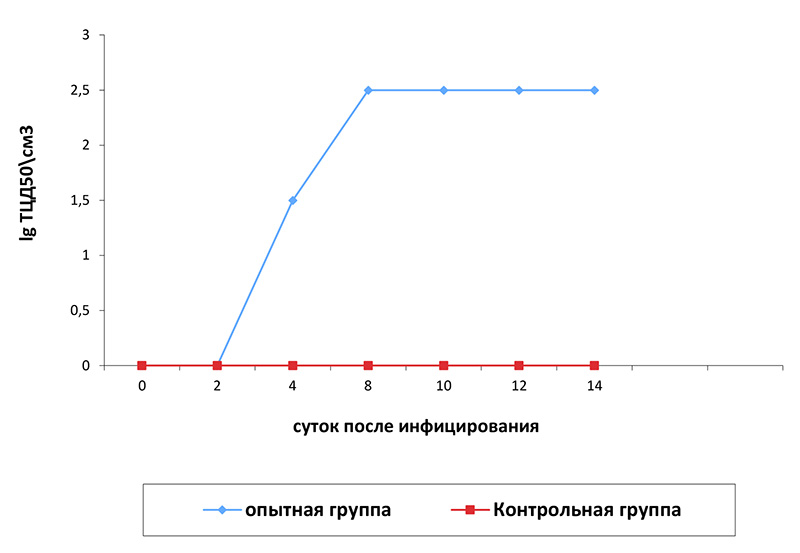
Рис. 1. Динамика содержания вируса РРСС в сыворотке крови поросят (приведены среднегеометрические значения величин для животных каждой группы)
Титр накопления вируса РРСС в легких и лимфатических узлах после патоморфологического исследования животных составил 102,0-2,5 ТЦД50/см3.
Клиническое состояние поросят контрольной группы на протяжении всего эксперимента оставалось без изменений, у животных не наблюдали сероконверсии, результаты ПЦР показали отсутствие генома вируса РРСС в сыворотке крови, легких и лимфатических узлах.
Результаты ИГХ по локализации вируса РРСС в тканях органов экспериментально зараженных поросят представлены на рис.2 – 5.
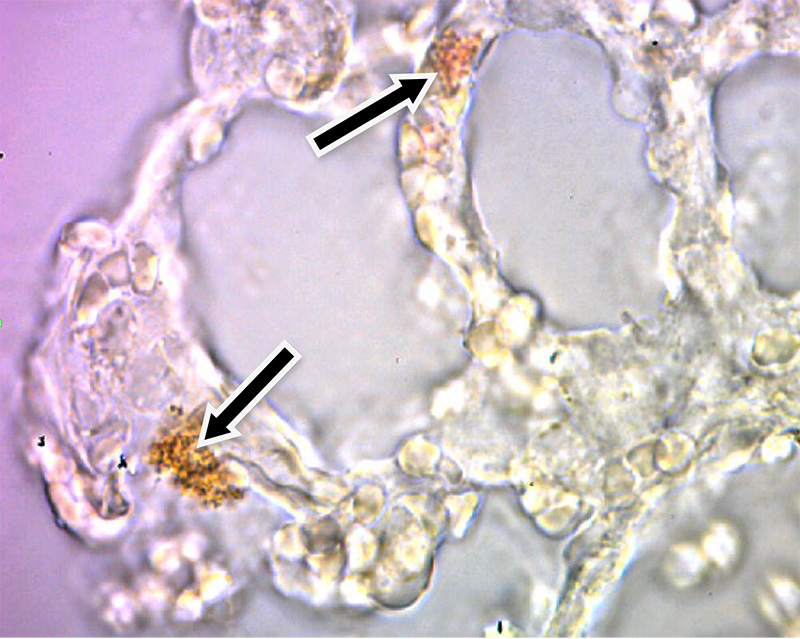
Рис. 2. Препарат легкого без докраски гематоксилином Майера (х200, стрелками показан альвеолярный макрофаг положительно реагирующий на РРСС)
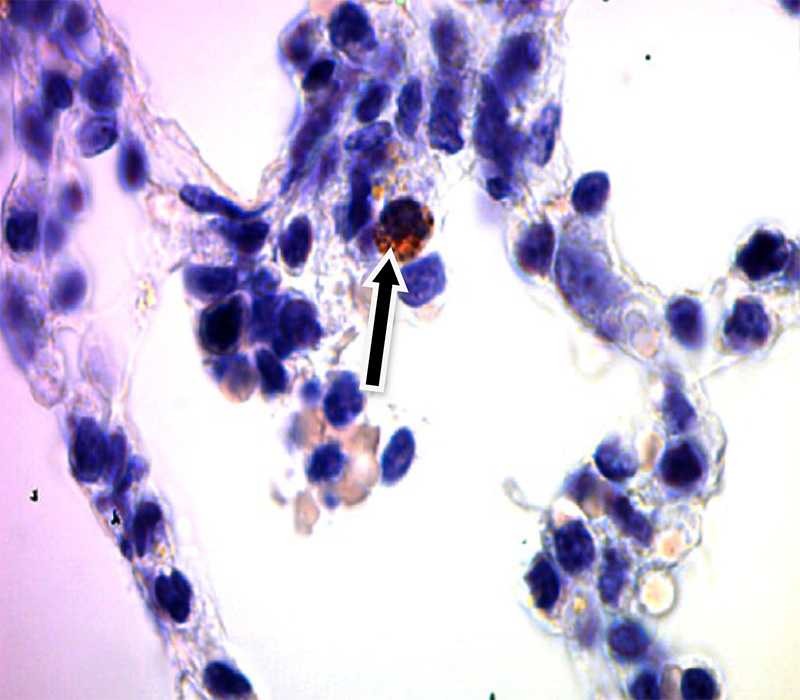
Рис. 3. Препарат легкого с докраской ядер клеток гематоксилином Майера (х200, стрелками показан альвеолярный макрофаг положительно реагирующий на РРСС)
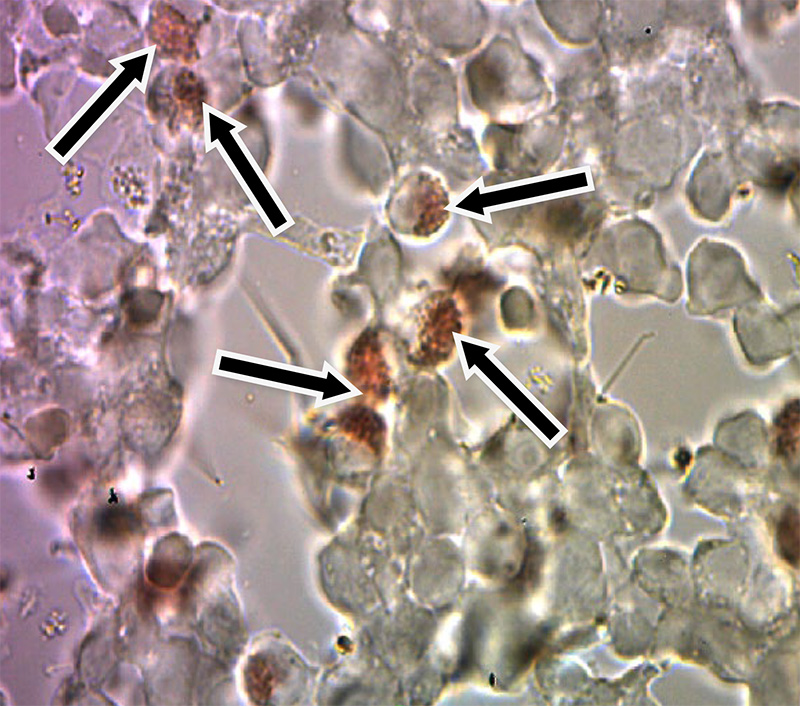
Рис. 4. Препарат лимфатического узла, без докраски гематоксилином Майера (х200, стрелками показан альвеолярный макрофаг положительно реагирующий на РРСС)
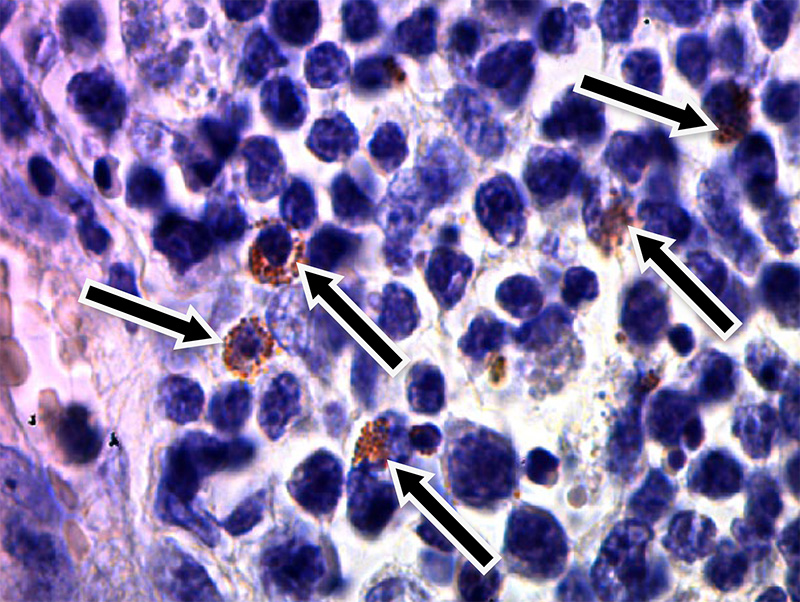
Рис. 5. Препарат лимфатического узла, с докраской ядер клеток гематоксилином Майера (х200, стрелками показан альвеолярный макрофаг положительно реагирующий на РРСС)
Как видно из представленных данных, в строме легкого хорошо виден альвеолярный макрофаг, на цитоплазме которого, после специфического окрашивания заметны конгломераты коричневого цвета, что является специфичной реакцией на присутствие вируса РРСС (рис. 3). Подобное окрашивание наблюдали на свободных макрофагах лимфатического узла (рис. 5). Аналогичный результат ИГХ зафиксировали на срезах легких и лимфатических узлов без дополнительной окраски гематоксилином Майера. Специфическое окрашивание инфицированных клеток в коричневый цвет свидетельствовало о положительной реакции ИГХ (рис. 2, 4).
РРСС, по номенклатуре МЭБ, – социально-экономически важное заболевание [10]. Появление в 2005 – 2013 гг. новых, высоковирулентных штаммов в Китае и Восточной Европе еще раз подтверждает важность своевременной диагностики РРСС и лабораторного анализа возбудителя.
В эндемичных по РРСС хозяйствах данный патоген выступает в роли одного из первичных возбудителей комплекса респираторных болезней свиней. В таких случаях рутинные диагностические исследования (ИФА, ПЦР), направленные на выявление ряда возбудителей инфекционных респираторных болезней свиней (цирковирус свиней второго типа, Mycoplasma hyopneumoniae, вирус гриппа свиней и др.), могут давать положительный результат. С помощью иммуногистохимического метода можно обнаружить антиген возбудителя в пределах поврежденной ткани, что способствует выявлению ведущего патогена в развитии патологии.
Анализ данных, полученных в результате экспериментального заражения животных низковирулентным штаммом вируса РРСС, показал, что метод ИГХ с использованием моноклональных антител к капсидному белку вируса РРСС позволяет выявлять антиген в инфицированных тканях организма.
Подтипы Европейского генотипа вируса РРСС значительно отличаются по патогенности. Так, штамм Lelystad вируса РРСС – прототипного вируса 1 подтипа Европейского генотипа является низковирулентным, в то время как представитель 3 подтипа (штамм «Лена» и другие) отличаются высокой патогенностью. Установлено, что высокопатогенные штаммы приводят к развитию большей вирусной нагрузки по сравнению с низковирулентными [8]. Таким образом, не смотря на низкую вирусную нагрузку в патологическом материале, разработанный нами метод ИГХ позволил детектировать наличие возбудителя РРСС в цитоплазме альвеолярных макрофагов в легких и в цитоплазме свободных макрофагов в лимфатическом узле.
Заключение. Способность моноклональных антител 4h7h9 взаимодействовать с Европейским и Американским генотипом вируса РРСС, позволяет использовать разработанный нами метод ИГХ для исследования материала при ассоциированных инфекциях, изучении особенностей репродукции вируса при хронической и стертой формах течения болезни, изучении биологических особенностей подтипов вируса.
Коллектив авторов выражает благодарность сотрудникам АНО «НИИ диагностики и профилактики болезней человека и животных» Л.В. Костиной, М.А. Корицкой, А.Ю. Козлову, М.В. Баландиной, В.В. Цибезову за оказанное содействие и всестороннюю помощь.
Литература
- Гребенникова Т. В., Забережный А. Д., Непоклонов Е. А. и др. Средства лабораторной диагностики репродуктивного и респираторного синдрома свиней. Ветеринария. 2005; 10:24 – 26.
- Жуков И. Ю., Шевченко И. В., Иголкин А. С. и др. Выявление клинико-анатомических, гистологических изменений при АЧС и локализации вируса в органах инфицированных животны. Российский ветеринарный журнал, серия «Сельскохозяйственные животные». 2015; 3:36 – 39.
- Кукушкин С. А., Байбиков Т. З., Фомин А. Е. Атипичный (высокопатогенный) репродуктивно-респираторный синдром свиней. Ветеринарная патология. 2008; 4:38 – 41.
- Орлянкин Б. Г., Алипер Т. И., Непоклонов Е. А. Инфекционные респираторные болезни свиней: этиология, диагностика и профилактик. Ветеринария. 2005; 11:3 – 6.
- Орлянкин Б. Г., Непоклонов Е. А., Алипер Т. И. и др. Диагностика и специфическая профилактика репродуктивно-респираторного синдрома свиней. Ветеринария. 2000; 10:16 – 19.
- Попова Н. Ю., Рабовская Л. А. Морфологические изменения в респираторной системе при репродуктивно- респираторном синдроме свиней. Аграрный вестник Урала. 2012; 11 – 2 (106):23, 24.
- Coons A. H. et al. Immunological properties of an antibody containing a fluorescence group. Soc. Exp. Biol. Med. 1941; 47:200 – 202.
- Frydas I. S. et al. Replication characteristics of porcine reproductive and respiratory syndrome virus (PRRSV) European subtype 1 (Lelystad) and subtype 3 (Lena) strains in nasal mucosa and cells of the monocytic lineage: indications for the use of new receptors of PRRSV (Lena). Res. 2013; 44:13.
- Stadejek T. et al. Molecular evolution of PRRSV in Europe: Current state of play. Microbiol. 2013; 165:21 – 28.
- World Organization of Animal Health (OIE). Porcine reproductive and respiratory syndrome. Manual of diagnostic test and vaccines for terrestrial animals. 2015.
- Yaeger M. The diagnostic sensitivity of immunohistochemistry for the detection of porcine reproductive and respiratory syndrome virus in the lung of vaccinated and unvaccinated swine. Vet. Diagn. Invest. 2002; 14:15 – 19.
- Zimmerman J. et al. Porcine reproductive and respiratory syndrome virus (porcine arterivirus). Diseases of swine, 10-th edition. – Wiley-Blacwell, 2012; 461 –

