УДК 619:616.988.27:634.4
Виталий Александрович Сергеев, д.б.н., профессор, консультант
Борис Григорьевич Орлянкин, д.в.н., профессор, заведующий лабораторией
Константин Петрович Алексеев, к.б.н., старший научный сотрудник
Научно-исследовательский институт диагностики и профилактики болезней человека и животны (г. Москва), orgotdel@rosvet.ru
Алексей Дмитриевич Забережный, д.б.н., профессор, заместитель директора, zaberezhny@mail.ru
ФГБНУ «Всероссийский научно-исследовательский институт экспериментальной ветеринарии имени Я.Р. Коваленко» (г. Моcква)
Тарас Иванович Алипер, д.б.н., профессор, генеральный директор, aliper@narvac.com
НПО «НАРВАК» (г. Москва)
Евгений Анатольевич Непоклонов, д.б.н., профессор, заместитель министра, ce.arcbxybabin@zpk.eh
Министерство сельского хозяйства Российской Федерации (г. Москва)
Рассмотрены преимущества и недостатки традиционных живых, субъединичных, химерных, векторных, ДНК-вакцин против классической чумы свиней. Анализируется стратегия вакцинопрофилактики болезни. Ключевые слова: вакцина, вакцинация, классическая чума свиней, свинья.
Vaccines and vaccination strategies against classical swine fever
V.A. Sergeyev, B.G. Orlyankin, K.P. Alekseyev, A.D. Zaberezhny, T.I. Aliper, Y.A. Nepoklonov
The review offers an analysis of the advantages and limitations of traditional live, subunit, chimeric, vectored and DNA-vaccines against classical swine fever. Vaccination strategies for the control of the disease are also discussed. Key words: vaccine, vaccination, classical swine fever, swine.
Классическая чума свиней (КЧС) – наиболее опасная вирусная болезнь домашних и диких свиней, приносящая большой экономический ущерб многим странам с развитым свиноводством. Она протекает в острой, хронической и инаппарантной формах, характеризуется высокой контагиозностью и вариабельной летальностью. По решению МЭБ, КЧС относят к группе особо опасных болезней, которые должны находиться под особым контролем ветеринарной службы всех стран.
Эпизоотия КЧС в Европе в конце прошлого века характеризовалась легким и хроническим течением заболевания с нарушениями функции воспроизводства, что было обусловлено широкой циркуляцией низковирулентных штаммов вируса. Несмотря на относительно легкое течение, КЧС причиняла большой экономический ущерб. Так в результате вспышек КЧС в 1993 – 1998 гг. в ряде стран ЕС (Нидерланды, Германия, Испания, Бельгия, Италия) пришлось уничтожить более 13 млн. свиней, а общий ущерб превысил 5 млрд. евро.
В течение нескольких десятилетий все поголовье свиней в Российской Федерации подлежит обязательной вакцинации против КЧС. Высокий уровень компартментализации свиноводческих хозяйств, а также длительное эпизоотическое благополучие страны по КЧС позволяют перейти к разработке программы эрадикации инфекции.
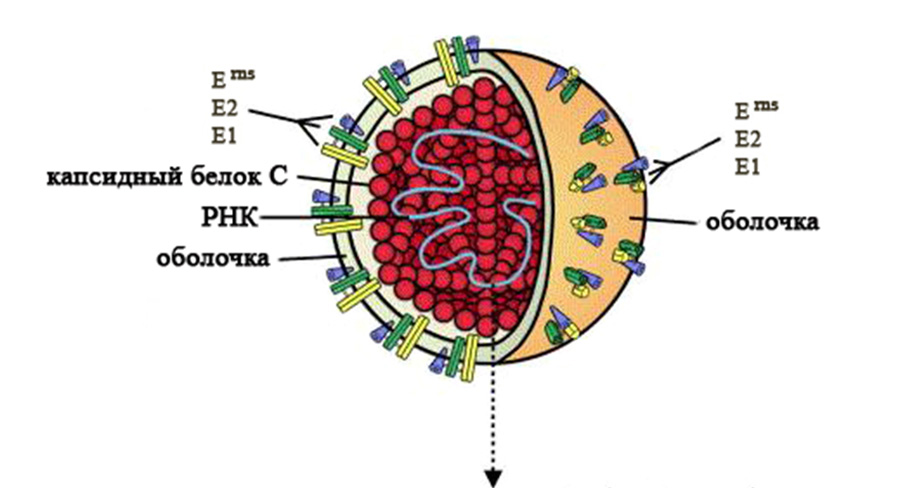
Возбудителем болезни является РНК-содержащий вирус, относящийся к роду Pestivirus семейства Flaviviridae. В этот же род входят вирусы диареи крупного рогатого скота первого и второго типов, а также вирус пограничной болезни. Вирионы вируса КЧС представляют собой сферические частицы диаметром 40 – 60 нм. Они состоят из нуклеокапсида и липопротеиновой оболочки. В состав нуклеокапсида входят РНК и белок С, оболочка образована 3 гликопротеинами – Erns (gp44/48), E1 (gp33) и E2 (gp55), которые за счет дисульфидных связей образуют комплексы (Erns гомодимер, Е1 – Е2 гетеродимер и Е2 гомодимер). Белок Erns обладает рибонуклеазной активностью, а Е2 является основным иммуногеном и индуцирует протективный иммунитет. Моноклональные антитела к этим белкам обладают вируснейтрализующей активностью. Гетеродимерный комплекс Е1 – Е2 обеспечивает проникновение вируса в клетку. Помимо антител к белку Е2, в организме инфицированных животных обнаруживают антитела к Erns и неструктурному белку NS3. Геном вируса КЧС состоит из 12,3 тыс. нуклеотидов и кодирует 4 структурных и 8 неструктурных белков (см. рисунок) [29].
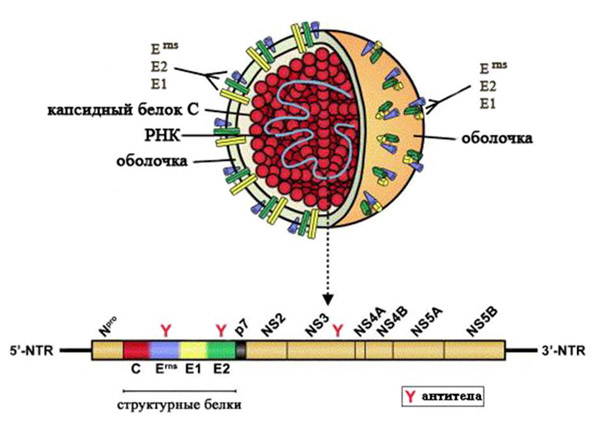
Структура вириона и генома вируса КЧС
В настоящем обзоре систематизирован многолетний опыт зарубежных и отечественных исследователей в области разработки вакцин против КЧС и стратегии их применения для специфической профилактики болезни.
Традиционные живые вакцины. Инактивированные вакцины против КЧС оказались малоэффективными, поэтому особое внимание было уделено разработке живых вакцин. Новая эра в специфической профилактике КЧС связана с получением китайского лапинизированного вакцинного штамма С (синонимы LC, LPC) и 4 культуральных вакцинных штаммов: в нашей стране – ЛК и КС, в Японии – GPE, во Франции – Thiverval. Все они безопасны для свиней разного возраста и физиологического состояния, обладают выраженной иммуногенностью, которая проявляется устойчивостью вакцинированных животных к экспериментальному летальному заражению вирулентным штаммом вируса КЧС [8, 9, 41].
В разработке и производстве живых вакцин против КЧС наметились 3 независимых направления: 1– вакцина из штамма С, размноженного в организме кроликов; 2 – модифицированные вакцины из штамма С, адаптированного и размноженного в различных культурах клеток; 3 – оригинальные вакцины из других аттенуированных штаммов (ЛК, КС, Thiverval, GPE), с самого начала аттенуированных и размноженных в различных культурах клеток. Все упомянутые вакцинные штаммы соответствовали требованиям OIE (2000 г.).
Первые исследования по получению и размножению вакцинного штамма вируса КЧС в клеточной культуре были проведены в СССР (1967 г.). С тех пор налажено серийное промышленное изготовление 3 живых вакцин с использованием двух клеточных систем: первичной культуры клеток почки эмбрионов свиньи – вакцина ВГНКИ [7] и культуры клеток тестикул ягнят – вакцины ЛК и КС [8].
Вакцинный штамм ЛК получили посредством длительного пассирования слабовирулентного полевого изолята вируса КЧС в первичной культуре и субкультуре клеток тестикул ягнят (ТЯ). Эти клеточные системы в последующем использовали для массовой репродукции штаммов ЛК и КС при изготовлении вакцин. Лабораторные и полевые испытания показали, что такие препараты по безопасности и иммуногенности подобны вакцине из штамма С. На основе филогенетического анализа и в соответствии с Европейской классификацией штамм С отнесен к подгруппе 1.1. (референтный штамм Alfort), а штаммы ЛК и КС – к подгруппе 1.2. (референтный штамм Breshia) [2].
В 1997 – 2010 гг. живую культуральную сухую вакцину КС производило НПО НАРВАК, а в последующем – предприятие Ветбиохим. На Покровском заводе биопрепаратов в течение 30 лет изготовляют вакцину ЛК-ВНИИВВиМ. Вакцина КС из клонированного штамма ЛК отличается от вакцины ЛК более высокой концентрацией вакцинного штамма и использованием роллерного способа культивирования клеток [4].
Вакцина ВГНКИ из штамма С, адаптированного и размноженного в первичной культуре клеток почки эмбриона свиньи, уступала вакцине ЛК-ВНИИВВиМ по содержанию вируса в 10 и более раз. Кроме того, технология приготовления вакцины ВГНКИ не исключала возможности ее эндогенной контаминации латентными вирусами свиней, в том числе полевым вирулентным вирусом КЧС.
Лапинизированный штамм С накапливался в культуре клеток почки ягнят в титре не выше 105 ИмД50/мл и оказался безопасным для супоросных свиноматок, новорожденных поросят и откормочных свиней. Иммунитет наступал в течение недели и сохранялся более года. Вакцинированные свиноматки передавали вируснейтрализующие антитела (ВНА) потомству с молозивом. Лиофилизированная вакцина сохраняла активность при 4 0С не менее 12 мес. Прививную дозу, равную 100 ИмД50, считали достаточной для контроля КЧС в хозяйствах [13].
Исходя из того, что при КЧС ведущую роль играет гуморальный иммунитет, изучали корреляцию вируснейтрализующих антител с иммунитетом у привитых вакциной Pestiffa свиней. Определяли защиту вакциной свиней от заболевания и гибели при интраназальном заражении (100 ИД50) вирулентным вирусом, его размножение и выделение из организма вакцинированных животных, а также горизонтальную передачу. У свиней с титром ВНА 1:12,5 – <1:50 проявлялись все клинические признаки болезни, но они не погибали. В организме животных с титром ВНА 1:50 – 1:300 возбудитель размножался, но не выделялся и не распространялся горизонтально, что имеет важное эпизоотологическое значение [37].
Вакцину Cidepest из штамма С, размноженного в культуре клеток почки свиньи (линия SK-6), применяли 6 – 8-недельным серонегативным поросятам в дозе 400 – 600 ТКИД50. Протективный иммунитет наступал на 7-й день и длился более 6 месяцев (срок наблюдения). Титр ВНА у этих животных через 6 – 12 и 26 недель после вакцинации достигал 1:16 – 1:256. Все иммунизированные животные после заражения вирулентным вирусом были защищены от заболевания и гибели, однако через 2 недели после заражения у них увеличился в несколько раз титр ВНА (1:200 – 1:1000). Это указывало на ограниченное размножение возбудителя в организме вакцинированных свиней, клинически полностью устойчивых к экспериментальному заражению. В дальнейшем линию клеток SK-6 адаптировали к росту в суспензионной культуре [38].
В перевиваемой линии РК-15 штамм С накапливался в более высоком титре, чем в первичных культурах клеток почек и тестикул поросят. В роллерной и суспензионной культурах на микроносителе Цитодекс-3 вирус достигал титра 8,0 lg ТКИД50/мл через 96 ч. Приготовленная из него вакцина Cellpest по безопасности и иммуногенности соответствовала аналогу из исходного лапинизированного штамма С [17].
Штамм С адаптировали к культуре клеток почки мини-свиньи (линия МРК), чего не удалось сделать при использовании линии клеток почки кролика RK-13. После 20 – 25 пассажей в культуре клеток МРК урожай вируса достиг 8,0 lg ТКИД50/мл. Через 30 дней после иммунизации изготовленной из него вакцины титр ВНА у поросят составлял 1:32 – 1: 256, а спустя 30 дней после контрольного заражения он повышался до 1:1024 – 1:4096. Заражение привитых поросят вирулентным штаммом возбудителя КЧС не вело к выделению агента с секретами и экскретами.
Результаты этих опытов показали, что живые культуральные вакцины на основе штамма С по безопасности и иммуногенности не уступают оригинальной лапинизированной вакцине, отличались от нее лишь более совершенной и производительной технологией [24].
Японский вакцинный штамм GPE— получили пассированием слабовирулентного полевого штамма ALD в разных культурах клеток при 30 0С. В отличие от исходного штамма он хорошо размножался в культуре клеток морской свинки (G-маркер) при 30 0С и плохо при 40 0С (Т-маркер). Испытание на поросятах подтвердило его безопасность и высокую иммуногенность. У привитого молодняка ВНА образовывались в титре 1:32 – 1:256. Геном штамма GPE- отличался от исходного родительского заменой 225 нуклеотидов. На его основе создали GPE- вакцину, которая при систематическом применении в комплексе с другими мерами контроля инфекции позволила ликвидировать КЧС в Японии [22].
Вакцинный штамм Thiverval получили из вирулентного штамма Alfort проведением более чем 170 пассажей в культуре клеток при 29 – 30 0С. Его можно идентифицировать in vitro несколькими маркерами. По безопасности и иммуногенности он подобен другим культуральным вакцинным штаммам и присутствует в организме вакцинированных свиней не более 10 –15 дней.
Вакцинные штаммы можно дифференцировать от полевых изолятов вируса КЧС посредством рестриктазного анализа ПЦР-продукта. Для расщепления ДНК-амплификатов 5'-некодирующей области генома вируса пользуются эндонуклеазой [43].
Вакцина ЛК в дозе 1000 – 10000 ИмД50 проявила выраженную эпизоотологическую эффективность в неблагополучных по КЧС хозяйствах. Однако она и другие аналогичные вакцины защищают от заболевания и гибели в основном взрослое поголовье свиней, они недостаточно эффективны для молодняка в период доращивания [1, 6].
Слабоиммунные свиноматки, предрасположенные к латентному инфицированию и последующей внутриутробной передаче возбудителя потомству, играют важную роль в поддержании КЧС в крупных хозяйствах, несмотря на вакцинацию. Трансплацентарное инфицирование поросят может происходить на любой стадии супоросности. В таких хозяйствах часть молодняка рождается латентно инфицированным, способным длительно носить и выделять вирус во внешнюю среду, не проявляя при этом клинических признаков болезни. Он заражает восприимчивых животных (в первую очередь слабоиммунных свиноматок и вновь родившихся поросят). Таковы механизмы стационарности КЧС в хозяйствах промышленного типа, несмотря на систематическую вакцинацию [3, 8].
Эпизоотологическая эффективность вакцинации в значительной мере зависит от популяционно-технологических факторов. Считается, что чем крупнее хозяйство, тем труднее ликвидировать в нем КЧС.
Сложность такой задачи и отсутствие прототипных решений в мировой практике вакцинопрофилактики требовали разработки новых нетрадиционных решений. Единственным правильным и возможным решением задачи, по нашему мнению, являлась гипервакцинация. Реализация такой стратегии требовала создания новой безопасной и эффективной вакцины, концентрация вируса в которой, по нашим расчетам, должна быть в 100 – 1000 раз выше, чем в существующих отечественных и зарубежных вакцинах [8].
Учитывая данные обстоятельства, разработали новую культуральную вакцину против КЧС, отвечающую указанным требованиям. Препарат, получивший название КС, по безопасности и иммуногенности отвечает требованиям МЭБ и отличается от остальных живых вакцин против КЧС более высокой концентрацией вируса (≈ 8,0 lg ИмД50/мл), получаемого при его репродукции in vitro. Вакцина КС нереактогенна и безопасна для свиней любого возраста, в том числе супоросных свиноматок и новорожденных поросят. Она нереверсибельна, не передается горизонтально, быстро создает продолжительный (не менее 2 лет) напряженный иммунитет у свиней независимо от возраста и наличия колостральных ВНА. Разработаны технология изготовления, методы контроля и условия применения сухой живой вакцины КС.
Основная цель гипервакцинации с применением вакцины КС состоит в прекращении циркуляции вирулентного вируса КЧС в неблагополучных хозяйствах путем создания максимально выраженного иммунитета практически у всего поголовья (в первую очередь у свиноматок и новорожденных поросят). При этом предстояло решить одну из главных задач – преодолеть генетически обусловленную низкую иммунореактивность у небольшой части свиноматок (примерно 10 – 15 %) и пассивный иммунитет у новорожденных поросят. В экспериментальных условиях установили, что для этого необходимо применять вакцину КС в больших дозах.
В промышленных комплексах, неблагополучных по КЧС, у свиней отмечают широкую вариабельность поствакцинального иммунитета. Степень его выраженности колеблется от минимального у матерей и небольшого пассивного иммунитета у их потомства до очень высокого уровня, обусловленного латентным инфицированием полевыми вирулентными штаммами возбудителя на фоне вакцинации. Поскольку невозможно разделить стадо свиней по степени инфицированности или выраженности иммунитета, необходимо вакцинировать и ревакцинировать все поголовье оптимально большими дозами (500 000 ИмД50).
Эффективность вакцины КС испытали в нескольких неблагополучных по КЧС свиноводческих комплексах России и Беларуси, в каждом из которых содержалось от 25 до 85 тыс. свиней. Анализ крови 1 – 3-дневных поросят в ПЦР показал, что в этих хозяйствах от 10 до 30 % потомства рождается инфицированным вирусом КЧС. Гибель поросят в таких комплексах в период доращивания на фоне применения вакцины ЛК-ВНИИВВиМ достигала 30 – 50 %.
Результаты вакцинации учитывали по титру специфических антител, наличию вирусоносителей и сохранности поросят в период доращивания. Гипервакцинация заметно повышала гуморальный иммунитет у свиней. Ревакцинация глубокосупоросных свиноматок способствовала увеличению титра вируснейтрализующих антител у матерей и потомства, не оказывая отрицательного влияния на клиническое состояние и репродуктивную функцию животных.
Таким образом, подтвердили эффективность новой стратегии вакцинопрофилактики КЧС, заключающейся в существенном увеличении дозы вакцины для всех возрастных групп свиней и новой тактике ее применения. Гипервакцинация позволила успешно купировать КЧС в свиноводческих предприятиях.
Главным недостатком перечисленных выше живых вакцин является то, что индуцируемые ими антитела не отличаются от таковых, образующихся после заражения полевыми штаммами возбудителя КЧС. Поэтому отличить инфицированных животных от вакцинированных особей серологическими методами невозможно.
Маркированные вакцины. Данную проблему решают с помощью стратегии DIVA (Differentiating Infected from Vaccinated Animals, означающего Дифференциацию Инфицированных и Вакцинированных Животных). Она основана на использовании маркированных вакцин и соответствующих иммуноферментных тест-систем, предназначенных для выявления антител к вирусным белкам, присутствующим или отсутствующим в вакцине. Наличие антител к вирусным белкам, не входящим в состав вакцины, свидетельствует об инфицировании животных.
Субъединичные вакцины разработаны на основе белка Е2, продуцированного в бакуловирусной системе в клетках насекомых [16, 18, 30, 32]. У вакцинированных им свиней в ИФА обнаруживают антитела к белку Е2, а у инфицированных полевыми штаммами вируса КЧС животных – к белку Erns. В качестве альтернативы можно использовать тест-систему, выявляющую антитела к неструктурному белку NS3.
Широкие испытания таких препаратов показали, что они безопасны, но по эффективности уступают традиционным живым вакцинам. Среди недостатков отмечают длительный период развития иммунитета (2 – 4 недели после вакцинации) и неполную защиту от горизонтальной и вертикальной передачи вирулентного возбудителя КЧС после контрольного заражения. Эти вакцины не подходят для оральной иммунизации кабанов [18, 39, 40].
В настоящее время производится только одна субъединичная вакцина – Porcilis Pesti (MSD Animal Health), содержащая белок Е2 штамма «Alfort/Tubingen» вируса КЧС и водно-масляный адъювант [15].
Субъединичные вакцины на основе пептидов вируса КЧС. Также разработаны экспериментальные вакцины на основе синтетических пептидов (15 – 40 аминокислотных остатков), перекрывающих различные части антигенных доменов (участков) белка Е2 [19, 31]. Пептидные вакцины безопасны, но недостаточно эффективны и при контрольном заражении вирулентным вирусом предохраняют не всех животных от заболевания, виремии и выделения возбудителя в окружающую среду. Они не лучше субъединичных вакцин на основе белка Е2 [15].
Субъединичные вакцины на основе белка Е2 и синтетических пептидов индуцируют только гуморальный иммунный ответ с участием Т-хелперов второго типа и плазматических клеток, синтезирующих антитела. Они не индуцируют клеточный иммунный ответ с участием Т-хелперов первого типа и цитотоксических Т-лимфоцитов, разрушающих зараженные клетки. Антитела не проникают через клеточную мембрану, и вирус внутри клетки надежно от них защищен.
Маркированные вакцины на основе химерных пестивирусов. Геном пестивирусов представлен однонитевой РНК позитивной полярности, обладающей инфекционностью. Единственная открытая рамка считывания кодирует полипротеин, состоящий из 3900 аминокислотных остатков. Вирусные и клеточные протеазы расщепляют его на 4 структурных и 8 неструктурных белков. Последние необходимы для размножения пестивирусов.
Все пестивирусы антигенно и генетически родственны. На белках их оболочки находятся перекрестно-реагирующие эпитопы. В перекрестной реакции нейтрализации титр антител в поликлональной сыворотке, по меньшей мере, в 10 раз выше с гомологичным, чем гетерологичными пестивирусами. Идентичность нуклеотидной последовательности геномной РНК у вируса диареи КРС первого типа и вируса КЧС составляет 75 %. Вирус диареи КРС размножается в организме жвачных и свиней, а вирус КЧС только в организме свиней [35].
Химерные пестивирусы созданы на основе инфекционных клонов комплементарной ДНК (кДНК) вируса КЧС или вируса диареи КРС. В инфекционном клоне кДНК цитопатогенного штамма СР7 вируса диареи КРС область, кодирующая последовательность белка Е2, заменена на таковую штамма Alfort/187 вируса КЧС. Химерный пестивирус обозначен как СР7_Е2alf и используется в качестве маркированной вакцины [34].
Вакцинный химерный вирус безвреден для домашних свиней, кабанов, телят, коз, овец и кроликов. Он размножается в основном в миндалинах, не передается другим животным и не выделяется с мочой, фекалиями и спермой, проявляет высокую стабильность как in vitro, так и in vivo [25].
Вакцина Suvaxyn CSF Marker (Zoetis) из химерного пестивируса СР7_Е2alf лицензирована Европейским медицинским агентством. Широкие испытания показали, что при внутримышечном и оральном применении она безопасна, а по эффективности сопоставима с традиционными живыми вакцинами против КЧС. Протективный иммунитет создается в течение 1 недели после внутримышечного введения препарата и сохраняется не менее 6 месяцев. Он обеспечивает защиту от различных генотипов возбудителя КЧС. Вакцина эффективна даже при наличии у иммунизируемых свиней антител к вирусу диареи КРС первого типа. При оральном применении препарата и иммунизации им животных, имеющих материнские антитела к вирусу КЧС, эффективность немного ниже, чем при вакцинации посредством внутримышечного введения и иммунизации молодняка без специфических колостральных антител, соответственно [14, 20, 21]. Иммунизированные им свиньи имеют антитела только к белку Е2, в то время как инфицированные полевым вирусом животные содержат антитела к белкам Erns и Е2. В настоящее время выпускаются 2 коммерческих набора для определения антител к белку Erns. В ходе широких испытаний один из наборов показал чувствительность 90 – 98 % с сыворотками инфицированных свиней и специфичность 89 – 96 % с таковыми вакцинированных животных. Заражение вакцинированных животных вирусом КЧС детектировалось с чувствительностью 82 – 94 %. Зарегистрированы перекрестные реакции со штаммами вируса диареи КРС и вируса пограничной болезни, а многократная вакцинация и низкое качество проб снижали специфичность показаний теста [33]. Наборы для идентификации инфицированных и вакцинированных животных все еще нуждаются в усовершенствовании [15]. Генетическую дифференциацию вакцинированных и инфицированных животных проводят с помощью ПЦР в режиме реального времени [26].
Живые маркированные вакцины против КЧС индуцируют сбалансированный гуморальный и клеточный иммунный ответ. Их легко адаптировать для оральной вакцинации кабанов. После оральной иммунизации, проводимой с применением приманок, которые содержат химерный пестивирус СР7_Е2alf, можно отличить вакцинированных животных от инфицированных [23]. Однако, следует иметь в виду, что поросята кабанов в первые 3 месяца жизни не поедают приманки, а питаются материнским молоком.
ДНК-вакцины. Плазмидную ДНК со встроенным геном протективного белка называют ДНК-вакциной, а введение ее в организм животных – ДНК-вакцинацией. Плазмидная ДНК представляет собой кольцевую ковалентно-замкнутую молекулу длиной 4 – 6 тыс. пар нуклеотидов. В ней имеется участок, ответственный за начало транскрипции (промотор), ген протективного белка и участок начала репликации плазмидной ДНК. Плазмидную ДНК репродуцируют в клетках кишечной палочки, очищают и вводят животным внутримышечно. Она поглощается клетками животных в небольшом количестве (0,01 – 1,0 %), транспортируется в ядро и транскрибируется с образованием информационной РНК, которая в цитоплазме обеспечивает синтез протективного белка. В организме животных плазмидная ДНК не размножается, не встраивается в хромосомы, и на нее не образуются антитела.
Все известные для профилактики КЧС ДНК-вакцины получены путем встраивания гена белка Е2 в плазмидную ДНК. Принцип маркирования реализуется за счет обнаружения антител к белку Erns или NS3. С целью стимуляции иммунного ответа в плазмиду встраивают гены цитокинов – регуляторов иммунного ответа [27]. Для защиты свиней от высоковирулентных штаммов вируса КЧС требуются большие дозы и многократная вакцинация. В качестве недостатков ДНК-вакцин отмечают высокую стоимость их производства и необходимость многократной иммунизации [15].
Вирусные векторные вакцины. Для создания векторных вакцин против КЧС используют различные аттенуированные ДНК-содержащие вирусы (осповакцины, Ауески, аденовирусы), в геном которых встроены гены протективных белков. В большинстве случаев вирусные векторы экспрессируют белок Е2, реже – Е2 и Erns, индуцирующие гуморальный и клеточный иммунные ответы. Некоторые векторные вакцины способны обеспечить полноценную защиту от вирулентного вируса КЧС, но лицензированных препаратов пока нет [18, 42].
Перспективны векторы, в которые встроены не только гены, контролирующие синтез протективных белков, но и ответственные за синтез медиаторов иммунного ответа. Вектор на основе рекомбинантного аденовируса человека экспрессирует белки Е2 и Erns вируса КЧС, а также интерлейкин-2, который активирует цитотоксические Т-лимфоциты и макрофаги. Двукратная внутримышечная иммунизация таким препаратом с интервалом в 3 недели обеспечивает защиту всех животных при контрольном заражении вирулентным штаммом вируса КЧС. Вакцинированных свиней отличают от естественно инфицированных посредством определения антител к белку NS3 [28].
Вакцины из транс-комплементарных делеционных мутантов (репликонов). Для разработки вакцин против КЧС сконструированы транс-комплементарные делеционные мутанты по белкам Е2 и Erns, которые способны к одноцикловой репликации, а потом исчезают (поэтому их называют «вирусами-самоубийцами»). Такие мутанты репродуцируют в рекомбинантных линиях клеток, экспрессирующих белки Е2 или Erns.
Эффективность вакцинации вирусами-мутантами зависит от способа их введения. Интрадермальная иммнизация полностью защищает от заражения вирулентными штаммами возбудителя КЧС, в то время как внутримышечная и оральная иммунизация – только частичную. Делеционные мутанты по гену белка Е2 менее эффективны, чем мутанты по гену белка Erns. Это свидетельствует о том, что белок Е2 является основным иммуногеном. Инфицированных животных отличают от вакцинированных по наличию антител к удаленному белку.
С целью повышения эффективности таких вакцин созданы репликоны, индуцирующие синтез интерферонов альфа и бета [15, 36].
В начале 2000 г. нами разработана экспериментальная рекомбинантная субъединичная вакцина против КЧС на основе белка Е2, продуцируемого в бакуловирусной системе. Двукратная внутримышечная иммунизация ею поросят 3-месячного возраста обеспечивала развитие гуморального иммунитета и защиту животных от контрольного заражения вирулентным штаммом Ши-Мынь вируса КЧС в дозе 105 ЛД50 [5, 11]. В настоящее время в АНО НИИ ДПБ разработана и проходит лабораторные испытания усовершенствованная модификация данного препарата.
Методами обратной генетики получен рекомбинантный вирус КЧС, предназначенный для создания живой маркированной вакцины против КЧС.
Заключение. Специфическая профилактика КЧС основана на применении безопасных и высокоиммуногенных живых вакцин. Наиболее эффективна вакцина КС, которая отличается от других аналогичных препаратов высоким содержанием вируса в одной прививной дозе (не менее 105 ИмД50). Живые вакцины не позволяют дифференцировать вакцинированных и инфицированных животных. Эта проблема решается с помощью маркированных вакцин – субъединичных, химерных, векторных и ДНК-вакцин. Химерные вакцины по эффективности сопоставимы с традиционными живыми вакцинами. Субъединичные вакцины на основе белка Е2 обеспечивают защиту животных от контрольного заражения вирулентным вирусом и позволяют применять стратегию DIVA.
Литература
- Вишняков И. Ф., Коломыцев А. А., Семенихин А. Л. и др. Иммунный ответ молодняка животных при применении вирусвакцин. Ветеринария. 1992; 3:25 – 34.
- Гребенникова Т. В., Забережный А. Д., Сергеев В. А. и др. Генетическая характеристика вакцинного штамма «КС» вируса классической чумы свиней: сравнительный анализ первичной последовательности генов поверхностных гликопротеинов Erns, El и Е2. Молекулярная генетика, микробиология и вирусология. 1999; 2:34 – 40.
- Коломыцев А. А., Павлов В. Х., Срибный Н. И. и др. Роль супоросных маток в эпизоотическом процессе классической чумы свиней. Ветеринария. 1991; 5:30 – 33.
- Корицкая М. А., Демкина М. М., Сергеев В. А. Культивирование вакцинного штамма вируса классической чумы свиней. Вопросы вирусологии. 2005; 1:42 – 46.
- Кривонос А. В., Забережный А. Д., Гребенникова Т. В., и др. Синтез и иммунохимические свойства рекомбинантного главного поверхностного гликопротеина Е2 вируса классической чумы свиней. Вопросы вирусологии. 2000; 2:29 – 36.
- Куриннов В. В., Стариков A. M., Лыска В. М. и др. Напряженность иммунитета против КЧС у животных в промышленных комплексах. Ветеринария. 2005; 1:18 – 23.
- Лихачев Н. В., Мищенко Н. К. Свойства культуральной вирусвакцины против чумы свиней из штамма «К». Ветеринария. 1974; 12: 36, 37.
- Сергеев В. А., Непоклонов Е. А., Алипер Т. И. Классическая чума свиней в промышленном свиноводстве. Ветеринария. 2001; 9:10 – 15.
- Сергеев В. А., Непоклонов Е. А., Алипер Т. И. Вакцины при классической чуме свиней. Ветеринария. 2005; 4:6 – 9.
- Сергеев В. А., Попов В. И., Рудобельский Э. В., Жестерев В. И. Способ получения аттенуированного штамма вируса чумы свиней. А.С. № 305710; 15.03.1971 г.
- Цибезов В. В., Богданова В. С., Забережный А. Д. и др. Применение рекомбинантного белка Е2 вируса классической чумы свиней для иммунизации животных. Вопросы вирусологии. 2000; 2:36 – 41.
- Aynaud J. M. Classic Swine Fever and Related Viral Infection. Martinus Nijhoff, Boston. 1988; 165 –
- Biront P., Leunen J., Vandeputte J. Inhibition of virus replication in the tonsils of pigs previously vaccinated with a Chinese strain vaccine and challenged oronasally with a virulent strain of classical swine fever virus. Vet. Microbiol. 1987; 14:105 –
- Blome S., Gabriel C., Schmeiser S. et al. Efficacy of marker vaccine candidate GP7_E2alf against challenge with classical swine fever virus isolates of different genotypes. Vet. Microbiol. 2014; 169:8 –
- Blome S., Mos C, Reimann I. et al. Classical swine fever vaccines – State-of-the-art. Vet. Microbiol. 2017; ???
- Bouma A., de Smit A. J., de Kluijver E. P. et al. Efficacy and stability of a subunit vaccine based on glycoprotein E2 of classical swine fever virus. Vet. Microbiol. 1999; 66:101 –
- Gaij A., Desmet A., Dubois N. et al. High titre hog cholera virus production on cytodex 3R microcarrier cultures. Arch. Virol. 1989; 105:113 –
- Dong X. N., Chen Y. H. Marker vaccine strategies and candidate CSFV marker Vaccine. 2007; 25:205 – 230.
- Dong X. N., Qi Y., Ying J. et al. Candidate peptide-vaccine induced potent protection against CSFV and identified a principal sequential neutralizing determinant on E2. Vaccine. 2006; 24:426 –
- Drager C., Schroder C., Konig P, et al, Efficacy of Suvaxyn CSF Marker (CP7_E2alf) in the presence of pre-existing antibodies against Bovine viral diarrhea virus type 1. Vaccine. 2016; 34:4666 –
- Eble P. L., Quak S., Geurts Y. et al. Efficacy of CSF vaccine CP7_E2alf in piglets with maternally derived antibodies. Vet. Microbiol. 2014; 174:27 –
- Edwards S., Fucusho Ao, Lefevre P. C. et al. Classical swine fever: the global situation. Vet. Microbiol. 2000; 73:103 –
- Feliziani F., Blome S., Petrini et al. First assessment of classical swine fever marker vaccine candidate CP7_E2alf for oral immunization of wild boar under field condicions. Vaccine. 2014; 32:2050 – 2055.
- Ferrari M. A tissue culture vaccine with lapinized Chinese (LC) strain of hog cholera virus (HCV). Comp. Immunol. Microbiol. Infect. Dis. 1992; 15:221 –
- Goller K. V., Drager C., Hoper D. et al. Classical swine fever virus marker vaccine strain CP7_E2alf: genetic stability in vitro and in vivo. Arch. Virol. 2015; 160:3121 –
- Leifer I., Depner К., Blome S. et al. Differentiation of C-strain Riems or CP7_E2alf vaccinated animals from animals infected by classical swine fever virus field strains using real-time RT-PCR. J. Virol. Methods. 2009; 158:114 –
- Li W., Mao L., Zhou B. et al. The swine CB81 enhances E2-based DNA vaccination against classical swine fever. Vaccine. 2015; 33:3542 –
- Li H., Gao R., Zhang Y. A promising trigene recombinant human adenovirus vaccine against classical swine fever virus. Viral. Immunol. 2016; 29:244 –
- Lindenbach B. D., Murray C. L., Thiel H. J. et al. Flaviviridae. In: Knipe D.M, Howley P. M. (Eds.). Fields Virology. Lippincott Williams and Wilkins, Philadelphia. 2013; 712 –
- Lipowski A., Drexler C. Pejsak Z. Safety and efficacy of a classical swine fever subunit vaccine in pregnant sows and their offspring. Vet. Microbiol. 2000; 77:99 –
- Liu S., Yu X., Wanf C, Quadruple antigenic epitope peptide producing immune protection against classical swine fever virus. Vaccine. 2006; 24:7175 –
- Moormann J., Bouma А., Kramps J. A. at al. Development of a classical swine fever subunit marker vaccine and companion diagnostic test. Vet. Microbiol. 2000; 73:209 – 219.
- Pannhorst K., Frohlich A., Staubach C. et al. Evaluation of an Erns-based enzyme-linked immunosorbent assay to distinguish Classical swine fever virus-infected pigs from pigs vaccinated with CP7_E2alf. J. Vet. Diagn. Invest. 2015; 27:449 –
- Reimann I., Depner K., Trapp S. et al. An avirulent chimeric Pestivirus with altered cell tropism protects pigs against lethal infection with classical swine fever virus. Virology. 2004; 322:143 –
- Simmonds P., Becher P., Collet M. S. et al. Family Flaviviridae. Virus Taxonomy. Ninth Report of the International Committee on Taxonomy of Viruses. Eds.: A.M,Q.King, M.J. Adams, E.B. Carstens, E.J. Lefkowitz. Elsevier Academic Press. 2012; 1003 –
- Suter, Summerfield. A., Thomann-Harwood L. J. et al. Immunogenic and replicative properties of classic swine fever virus replicon particles modified to induce IFN-alpha/beta and carry foreign genes. Vaccine. 2011; 29:1491 – 1503.
- Terpstra C., Wensvoort G. The protective value of vaccine-induced neutralising antibody titres in swine fever. Vet. Microbiol. 1988; 16:123 –
- Terpstra C., Woortmeyer R., Barteling S. J. Development and properties of a cell culture produced vaccine for hog cholera based on the Chinese strain. Dtsch. Tierarztl. Wschr. 1990; 97:77 –
- Terzic S., Jemersic L., Lojkic M. et al. Comparison of antibody
values in sera of pigs vaccinated with a subunit or an attenuated
vaccine against classical swine fever. Vet. Res. Commun. 2003;
27:329 – - Van Aarle P. Suitability of an E2 subunit vaccine of classic swine fever in combinant with the E (rns)-marker-test for eradication through Dev. Biol. (Basel). 2003; 114:193 – 200.
- Van Oirschot J. T. Vaccinology of classical swine fever: from lab to field. Vet. Microbiol. 2003; 96:367 –
- Wang Y., Yuan J., Cong X. et al. Generation and efficacy evaluation of a recombinant pseudorabies virus variant expressing the E2 protein of classical swine fever virus in pigs. Clin. Vaccine Immunol. 2015; 22:1121 –
- Zaberszhny A. D., Grebennikova T. V., Kurinnov V. V. et al. Differentiation betveen vaccine strain and field isolates of classical swine fever virus using polymerase chain reaction and restriction test. Dtsch. Tierarztl. Wschr. 1999; 106:394